酸化 は、原子、グループ、またはイオン種による電子の損失プロセスに付けられた名前です。 化学反応. それはの増加から識別されます NOX 反応物と生成物を比較するときの種または原子の(酸化数)。
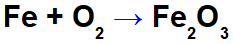
鉄の酸化式。
たとえば、上記の式では、各参加者のNOXを示すことができます。
試薬鉄(Fe):NOX 0であるため、 単体;
試薬中の酸素(O):単体であるためNOX0を含みます。
製品中の酸素:アルカリ金属に結合していないため、NOX-2が含まれています。 アルカリ土類 または水素形成 過酸化物 また スーパーオキシド;
製品中の鉄:鉄のNOXに2(原子数)を掛けたもの+酸素のNOXに3を掛けたものの合計は、複合物質であるため0になる必要があるため、NOX + 3になります。
x.2 + 3。(-2)= 0
2x-6 = 0
2x = +6
x = + 6
2
x = +3
試薬鉄(0)と生成物(+3)のNOXを比較すると、増加が見られました。 酸化. の発生は注目に値します 酸化 例の酸素で発生するように、NOxの減少によって識別される還元(電子の獲得を意味する)の現象を常に伴います。
あまりにも読んでください:酸化数(NOX)の決定
酸化が発生する状況の例:
1. 燃焼

材料の燃焼も酸化を示します。
燃焼 の存在下で発生するすべての化学反応です 燃料 任意の酸化性酸素ガス(O2)、熱と光の生成をもたらします。 すべての燃焼反応で発生します 酸化.
2. いくつかの有機反応
以下にリストされた手段の存在下で起こるすべての有機反応において、 酸化:
二クロム酸カリウム(K2Cr2O7)または過マンガン酸カリウム(KMnO4);
強酸または強塩基の存在;
オゾンガス(O3)金属亜鉛(Zn)と水(H)の存在下2O)。
3. バッテリーまたはバッテリー

バッテリーは、常に酸化が発生するデバイスです。
スタック またはバッテリーは、化学物質を保存する電気化学デバイスです。 これらの物質の1つは酸化を受け、もう1つは還元されて、電流が生成されます。
4. 電解
電解 は、塩を含む水溶液に電流を流す化学プロセスであり、これらの材料に存在する陰イオンの酸化を促進することになります。 すべての電気分解には、 酸化.
私によって。DiogoLopesDias
ソース: ブラジルの学校- https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-oxidacao.htm

