*アレニウスの理論:
水性媒体の電気伝導率に関する彼の実験に基づいて、化学的、物理的および数学的 スウェーデンのSvanteAugust Arrhenius(1859-1927)は、1884年に、酸と 拠点:

したがって、一般的に、次のようになります。
H+ + H2O→H3O+
例:
HCl + H2O→H3O++ Cl-
HNO3+ H2O→H3O+ +いいえ3-
H2のみ4+ 2H2O→2H3O+ + OS42-

例:
NaOH→Na + + OH-
Ca(OH)2 →Ca2+ + 2 OH-
*ブレンステッド-ローリー理論:
独立して、デンマークのヨハンス・ニコラウス・ブレンステッド(1879-1947)とイギリスのトーマス・マーチン・ローリー (1874-1936)、同じ年にブレンステッド-ローリー理論として知られている別の酸塩基理論を提案しました。 以下:

この場合、水素イオンは陽子と見なされます。 これは、青酸がプロトンを水に供与する次の反応で見られます。したがって、水は塩基として機能します。
HCN + H2O→CN- + H3O+
この反応は、ヒドロニウムイオン(H3O+)陽子をCNイオンに供与することができます-. したがって、ヒドロニウムイオン(H3O+)酸およびCNとして機能します- ベースとして。
CN- + H3O+→HCN + H2O
*ルイス理論:
この理論は、アメリカの化学者ギルバートニュートンルイス(1875-1946)によって作成され、次のように述べています。

この理論は新しい概念を導入し、より包括的ですが、ブレンステッド-ローリー理論を無効にするものではありません。 すべてのルイス酸はブレンステッド酸であるため、すべてのルイス塩基はブレンステッド塩基です。 これは、プロトンが電子を受け取るためです。つまり、ルイス酸はルイス塩基の孤立電子対に結合できます。
ルイスの場合、酸塩基反応は、より安定した配位共有結合の形成で構成されます。 したがって、ルイス塩基がルイス塩基に電子対を提供すると、両方が電子対を形成します。 例のように、両方の電子が一方の原子から来る配位共有結合 ベローズ:
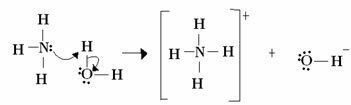
この場合、アンモニアは2つの電子をプロトンに供与し、したがってプロトンのレシーバーとなるため、ルイスおよびブレンステッド塩基として機能します。 さらに、水素(プロトン)とアンモニアの間に共有結合が形成されました。
水はルイスとブレンステッド酸であり、プロトンを供与して電子を受け取るため、水から形成された水酸化物の酸素が余分な電子対を持っていることに注目してください。

ジェニファー・フォガサ
化学を卒業
ブラジルの学校チーム。
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm

