1960年にライナス・ポーリングによって作成された軌道のモデルによると、 分子は、関与する元素の不完全な軌道の融合または相互侵入によって発生します。 リンク。 したがって、要素の軌道が不完全な場合(電子が1つしかない場合)、共有結合しか作成できないと結論付けられます。 不完全な軌道が2つある場合は、最大2つの接続を行うことができます。
ただし、原子番号が6(Z = 6)に等しい元素炭素原子の原子軌道を見てください。
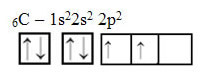
不完全な軌道が2つあるため、最大で2つのバインディングのみを実行する必要があることに注意してください。 しかし、それは彼に起こることではありません。 多くの人が知っているように、炭素は4つの結合(4価)を作るので、この軌道モデルは炭素の場合を説明していません。
この行き詰まりを終わらせるために、この問題をよりよく説明する新しい理論が作成されました。 ハイブリダイゼーション理論。

これは、混成が純粋な軌道の「混合」であることを意味します。
炭素の場合、ハイブリダイゼーションには次の3つのタイプがあります。sp3、sp2 およびsp。
ハイブリダイゼーションがどのように発生するかを理解するために、最初のタイプの炭素ハイブリダイゼーションであるspタイプを見てみましょう。3:
このタイプの混成は、メタン分子(CH4). 中心元素である炭素と4つの水素の間に4つの同一の共有結合があることに注意してください。 だから、不完全な水素軌道が何であるかを見てください:
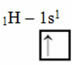
各水素は不完全なs型軌道を持っているため、もう1つの電子を受け取る必要があります。つまり、各水素は炭素と1つの共有結合しか作成しません。 そのため、炭素には4つの不完全な軌道が必要です。 これはどのように起こりますか? ハイブリダイゼーションを通して。
2s軌道からの電子がエネルギーを吸収すると、空の2p軌道に移動します。 したがって、この2sから2pサブレベルへの電子のジャンプは、電子の「促進」であると言えます。 このようにして、炭素は励起状態または活性化状態のままであり、共有結合を実行するために4つの混成軌道を利用できます。
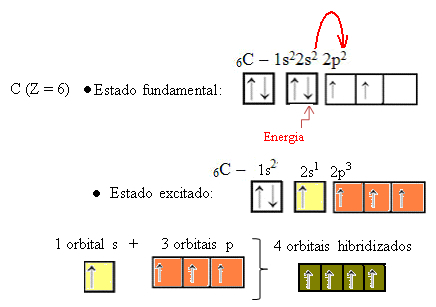
形成されたハイブリッド軌道は互いに同等ですが、元の純粋な軌道とは異なることに注意してください。
このようにして、4つの水素原子のそれぞれのs軌道間の結合は、これらの4つの混成炭素軌道で発生します。
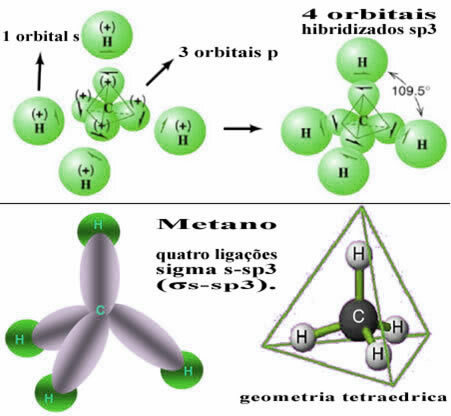
上で見たように、メタン分子は規則的な四面体構造を持ち、各頂点に4つの電子雲があり、隣接する角度は109°28 ’です。 各水素のs軌道と混成sp軌道の間に結合ができたので
3 接続ごとに、 4つのシグマs-spリンク3 (σs-sp3).
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm

