ヘスの法則により、化学反応を受けた後に物質に存在するエネルギー量であるエンタルピー変動を計算できます。 これは、エンタルピー自体を測定することはできませんが、その変動を測定することができないためです。
ヘスの法則は、熱化学の研究の根底にあります。
この法則は、以下を確立したジェルマン・アンリ・ヘスによって実験的に開発されました。
化学反応のエンタルピー変化(ΔH)は、反応の数に関係なく、反応の初期状態と最終状態にのみ依存します。
ヘスの法則はどのように計算できますか?
エンタルピーの変化は、(反応後の)最終エンタルピーから(反応前の)初期エンタルピーを差し引くことで計算できます。
ΔH= Hf -H私
それを計算する別の方法は、各中間反応のエンタルピーの合計を使用することです。 反応の数と種類に関係なく。
ΔH=ΔH1 +ΔH2
この計算では初期値と最終値のみが考慮されるため、中間エネルギーはその変動の結果に影響を与えないと結論付けられます。
これはの特定のケースです 省エネの原則、 熱力学の第一法則.
また、ヘスの法則は数式として計算できることも知っておく必要があります。 これを行うには、次のアクションを実行できます。
- 化学反応を逆にします。この場合、ΔHの符号も逆にする必要があります。
- 方程式を乗算すると、ΔHの値も乗算する必要があります。
- 方程式を除算すると、ΔHの値も除算する必要があります。
についてもっと知る エンタルピー.
エンタルピー図
ヘスの法則は、エネルギー図を通じて視覚化することもできます。
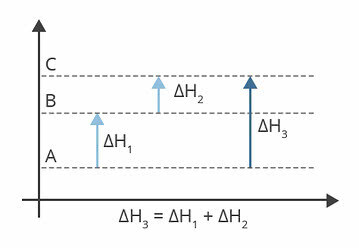
上の図は、エンタルピーレベルを示しています。 この場合、受けた反応は吸熱反応です。つまり、エネルギー吸収があります。
ΔH1 AからBに発生するエンタルピーの変化です。 122kjだとします。
ΔH2 BからCに発生するエンタルピーの変化です。 224kjだとします。
ΔH3 AからCに発生するエンタルピーの変化です。
したがって、ΔHの値を知ることは私たちにとって重要です3, これは、AからCへの反応エンタルピーの変化に対応しているためです。
ΔHの値を見つけることができます3、各反応のエンタルピーの合計から:
ΔH3 =ΔH1 +ΔH2
ΔH3 = 122 kj + 224 kj
ΔH3 = 346 kj
またはΔH= Hf -H私
ΔH= 346 kj – 122 kj
ΔH= 224 kj
入試:段階的に解決
1. (Fuvest-SP)次の反応に関連するエンタルピー変動に基づく:
N2(g) + 2 O2(g) →2いいえ2(g) ∆H1 = +67.6 kJ
N2(g) + 2 O2(g) →N2O4(g) ∆H2 = +9.6 kJ
NO二量体化反応に伴うエンタルピー変動が予測できる2 に等しくなります:
2 NO2(g) →1N2O4(g)
a)-58.0 kJ b)+58.0 kJ c)-77.2 kJ d)+77.2 kJ e)+648 kJ
解決:
ステップ1:最初の方程式を逆にします。 それはNO2(g) グローバル方程式によれば、反応物側に移動する必要があります。 反応を逆にすると、ΔH1も符号を逆にして、負に変更することに注意してください。
2番目の方程式は保存されています。
2いいえ2(g) →N2(g) + 2 O2(g) ∆H1 = - 67.6 kJ
N2(g) + 2 O2(g) →N2O4(g) ∆H2 = +9.6 kJ
ステップ2:Nに注意してください2(g) 製品や試薬に現れ、2molのOでも同じことが起こります2(g)。
2いいえ2(g) → N2(g)+ 2 O2(g)∆H1 = - 67.6 kJ
N2(g) + 2 O2(g) →N2O4(g) ∆H2 = +9.6 kJ
したがって、それらをキャンセルすると、次の式が得られます。
2いいえ2(g) →N2O4(g).
ステップ3:グローバル方程式に到達したことがわかります。 次に、方程式を追加する必要があります。
∆H = ∆H1 + ∆H2
∆H = -67.6 kJ + 9.6 kJ
∆H =-58kJ⇒代替案A
∆Hの負の値から、熱の放出を伴う発熱反応であることがわかります。
詳細については、以下もお読みください。
- 熱化学
- 熱化学に関する演習
- 吸熱および発熱反応
- 熱力学の第二法則
演習
1. (UDESC-2012)式1に示すように、メタンガスを燃料として使用できます。
CH4(g) + 2O2(g) →CO2(g) + 2H2O(g)
以下の必要と思われる熱化学方程式とヘスの法則の概念を使用して、方程式1のエンタルピー値を取得します。
Ç(s) + H2O(g) →CO(g) + H2(g) ΔH= 131.3 kJ mol-1
CO(g) +½2(g) →CO2(g) ΔH= – 283.0 kJ mol-1
H2(g) +½2(g) →H2O(g) ΔH= – 241.8 kJ mol-1
Ç(s) + 2H2(g) →CH4(g) ΔH= – 74.8 kJ mol-1
式1のエンタルピー値(kJ)は次のとおりです。
a)-704.6
b)-725.4
c)-802.3
d)-524.8
e)-110.5
c)– 802.3
2. (UNEMAT-2009)ヘスの法則は、熱化学の研究において基本的に重要であり、次のように述べることができます。 「化学反応におけるエンタルピーの変化は、の初期状態と最終状態にのみ依存します。 反応"。 ヘスの法則の結果の1つは、熱化学方程式を代数的に扱うことができるということです。
与えられた方程式:
Ç (黒鉛) + O2(g) →CO2(g) ΔH1 = -393.3 kj
Ç (ダイヤモンド) + O2(g) →CO2(g) ΔH2 = -395.2 kj
上記の情報に基づいて、グラファイトカーボンからダイヤモンドカーボンへのエンタルピー変化を計算し、正しい選択肢にチェックマークを付けます。
a)-788.5 kj
b)+1.9 kj
c)+788.5 kj
d)-1.9 kj
e)+98.1 kj
b)+1.9 kj