THE 蒸留 これは、液体が気化してから凝縮する沸騰によって行われる均一な混合物の分離プロセスの1つです。 したがって、分離される混合物は異なる沸点を持っています。
言い換えれば、蒸留は、混合物の加熱と冷却によって行われる混合物の分離の物理化学的プロセスです。 混合物を加熱すると、沸点が最も低い、つまり揮発性が最も高い物質が最初に蒸発します。
蒸留は、化学実験室や産業で特定の機器(コンデンサー、温度計、 蒸留、ブンゼンノズル、ビーカー、加熱マントル、分留塔)、例えば、水をアルコールから、または水をアルコールから分離する場合 塩。
蒸留プロセスの自然な例は、寒い日に水滴が凝縮するときに観察されます。 さらに、いわゆる蒸留飲料(カシャーサ、ウォッカ、ブランデー、テキーラ、ラム酒、ウイスキー)は、古くから使用されている分別蒸留プロセスによって製造されます。
蒸留の種類
蒸留は、別々の混合物の性質に応じて2つの方法で行うことができます。
簡単な蒸留
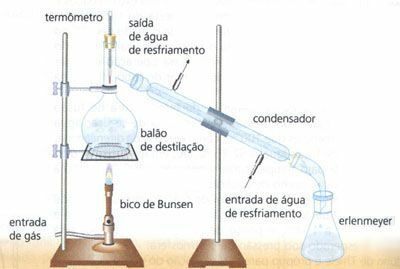 簡単な蒸留
簡単な蒸留
固体と液体の均一な混合物、例えば水(H2O)塩(NaCl)の。 このように、水は加熱によって蒸発し、それは次の形で凝縮器を通過します 液体(水滴)、塩はと呼ばれる容器に保持され、分離されます 蒸留。
分別蒸留
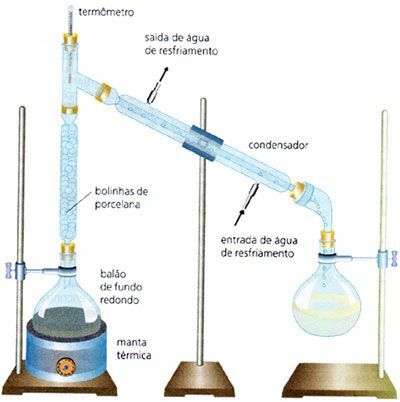 分別蒸留
分別蒸留
業界で広く使用されているのは、液体と液体の均一な混合物を分離することです。 例:水とアルコール(水の沸点は100°C、エチルアルコールの沸点は は78°Cです)。 それは非常に近い沸点を持つ混合物を通して実行されます。 単純な蒸留プロセスとは異なり、この場合は分留塔があります。
石油蒸留
石油製品(ガソリン、灯油、燃料油、パラフィン、アスファルト)を得るために、蒸留プロセス 分別は、沸点が最も低い液体が最初に分離されて、沸点が最も高い液体に到達する場合に使用されます。 沸騰。
覚えておいてください 石油 これは、いくつかの有機成分、特に炭化水素(炭素および水素分子)で構成される天然物質です。
共沸蒸留
共沸蒸留は、混合物の分離が共沸混合物を形成するときに発生します。つまり、混合物の揮発性とポイントが低くなります。 塩酸(HCL)や水などの簡単な蒸留方法では分離できない一定の沸点 (H2O)。
おもしろ情報:ご存知ですか?
蒸留水(脱塩水)は、蒸留によって得られる純粋な物質であり、一般的に実験室で使用されます。 私たちが飲む水は純粋ではないことに注意してください。つまり、ミネラル塩が含まれています。 しかし、蒸留水は人間の消費だけでなく、腎臓結石などのいくつかの病気の治療にも使用できます。
記事を読んであなたの研究を補完する:
- 融点と沸点
- 液化または結露
- 気化
- 混合物の分離
コメントされたフィードバックで入試の質問を確認してください: 混合分離に関する演習.



