炭化水素、別名 炭化水素は、その組成が次の原子のみを含む有機化合物です。 炭素 (C)およびから 水素 (H)、したがって一般式CバツHy.
炭化水素は、水素原子が結合する炭素構造で構成されています。 共有結合.
有機化学において最も重要な化合物です。
すべての種類の炭化水素は酸化しやすいため、熱を放出します。 それらのほとんどは水溶性ではありません。
天然炭化水素は、地球の内部で形成される化合物です(から150km以上 深さ)高圧で、地質学的プロセスを通じて低圧のゾーンに到達します。
炭化水素はどこにありますか?
炭化水素の主な供給源は石油です。 このため、炭化水素は次のようないくつかの誘導体に存在します。 灯油, パラフィン, 天然ガス, ガソリン, ワセリン, ディーゼルオイル, LPG (液化石油ガス)、 ポリマー (プラスチックやゴムなど)、とりわけ。
この有機化合物は、ブラジルのエネルギーマトリックスの48%を構成しています。
炭化水素の組成の一部を構成する炭素鎖は 四価つまり、4つの接続を確立できます。
炭素は他の炭素原子や水素と結合することができます 簡単なリンク, ダブルス または トリプル.
炭化水素の分類
炭化水素の分類は、次の3つの特異性に基づいています。 形 主な炭素鎖の 接続 炭素鎖の アルキルラジカルの存在 炭素鎖と ヘテロ原子の存在 炭素鎖を分割します。
についてもっと知る 水素.
主な炭素鎖形状
主な炭素鎖の形状に関して、炭化水素の分類はに細分されます 脂肪族 そして サイクリック.
これらの炭素鎖の各形態が何で構成されているかを確認してください。
脂肪族炭化水素
脂肪族炭化水素は炭素鎖によって形成されます 開いた または 非巡回. これらのチェーンでは、炭素は末端です。
例:
アルカン
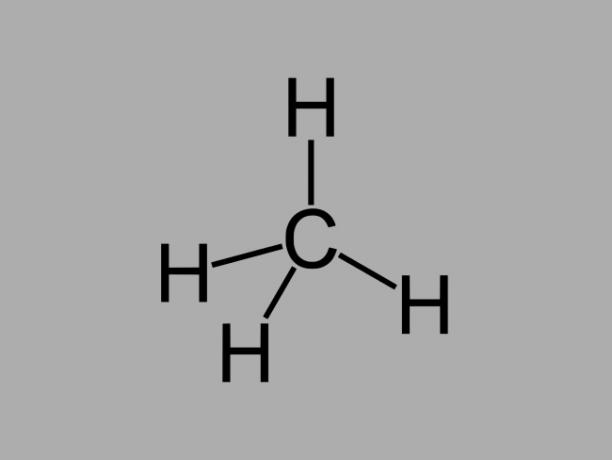
アルカン炭化水素、別名 パラフィン または パラフィン系は、炭素間に単結合しかない油性化合物です。
アルカンの一般式はCです。番号H2番号 + 2(n =任意の整数)。
アルケン
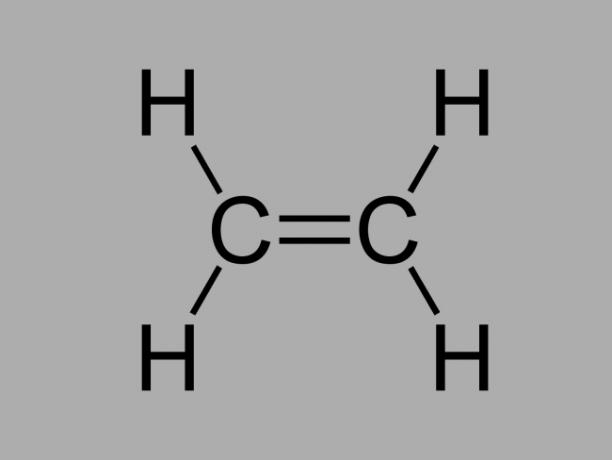
とも呼ばれている オレフィン, アルケン または エチレン炭化水素、アルケンは反応性の低い化合物であり、炭素間に二重結合があります。
アルケンの一般式はCです。番号H2番号.
アルキン
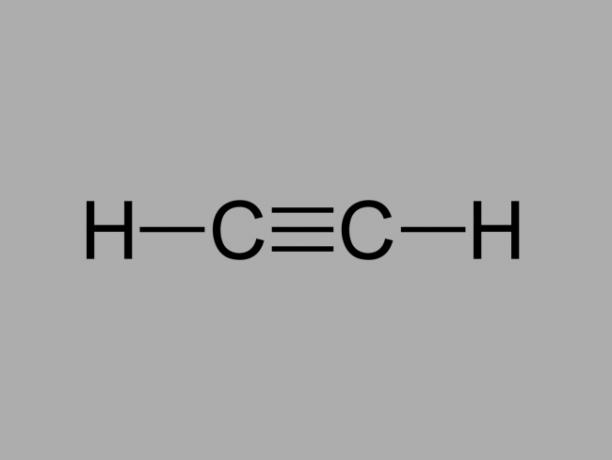
とも呼ばれている メチルアセチレン、アルキンは、炭素間の既存の結合が3倍になる炭化水素です。
アルキンの一般式はCです。番号H2番号-2.
アルカジエン

ジエンまたはジオレフィンとも呼ばれるアルカジエンは、炭素間の結合が二重になっている炭化水素です。
アルカジエンの一般式はCです。番号H2番号-2.
環状炭化水素
環状炭化水素は、閉じたまたは環状の炭素鎖によって形成されます。 これらの鎖には末端炭素がありません。
例:
サイクラン
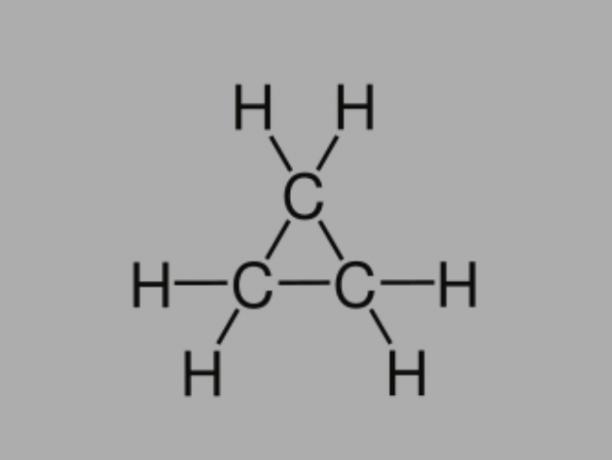
とも呼ばれている シクロアルカン, シクロパラフィン または ナフテン系炭化水素、シクロアルカンは単結合で構成される飽和炭化水素です。
それは閉じた炭素鎖を持ち、その一般式はCです番号H2番号.
サイクロン

とも呼ばれている シクロアルケン、サイクレンは不飽和炭化水素であり、二重結合で構成されています。
サイクレンは閉じた炭素鎖を持ち、その一般式はCです。番号H2番号−2.
サイクリスト
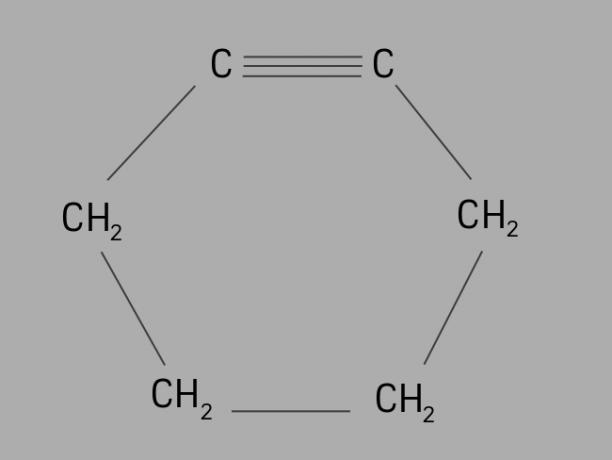
とも呼ばれている シクロアルキン または シクロアルキン、サイクリンは環状で不飽和の炭化水素です。
それは三重結合を持つ閉じた炭素鎖によって形成され、その一般式はCです番号H2番号-4.
芳香族

または

とも呼ばれている アリーナ、芳香族炭化水素は二重結合によって形成される不飽和化合物です。
芳香族化合物は、閉じたまたは環状の炭素鎖を持ち、その一般式はCです。6H6.
炭素鎖の結合の種類
炭素鎖の結合の種類に応じて、炭化水素は次のように分類できます。 飽和 または 不飽和.
これらの各分類が何で構成されているかを以下に示します。
飽和炭化水素
飽和炭化水素はによって形成されます 簡単なリンク.
例:アルカン、サイクラン。
不飽和炭化水素
不飽和炭化水素はによって形成されます 二重結合 または トリプル.
例:アルケン、アルキン、アルカジエン。
アルキルラジカルの存在
アルキルラジカルの存在に関して、炭化水素は炭素鎖を持つことができます 正常 または 分岐.
通常の炭素鎖
通常の炭素鎖炭化水素にはアルキルラジカルがありません。
例:ペンタン
分岐炭素鎖
炭化水素が分岐炭素鎖を持っている場合、それはその主炭素鎖がアルキルラジカルを持っていることを意味します。
例:メチルプロパン
炭素鎖を分割するヘテロ原子の存在
連続する炭素鎖は、ヘテロ原子の存在に応じて分割される場合と分割されない場合があります。
均質な炭素鎖
炭化水素が均一な主炭素鎖を持っている場合、それはこの鎖が 分割されていません ヘテロ原子による。
不均一な炭素鎖
炭化水素が不均一な主炭素鎖を持っている場合、この鎖は スプリットカーボンチェーン ヘテロ原子による。
炭化水素の命名法
炭化水素の命名法は、次の3つの部分の組み合わせによって定義されます。

接頭辞は炭素の量を識別し、中間体は結合のタイプを識別し、接尾辞は化合物が属する機能(この場合は炭化水素のクラス)を示します。
炭化水素を指定するために組み合わされる接頭辞と中間体のリストについては、以下を参照してください。
プレフィックスリスト
| 炭素数 | プレフィックス |
|---|---|
| 1 | 会った- |
| 2 | その他- |
| 3 | 支柱- |
| 4 | だが- |
| 5 | ペント- |
| 6 | 16進数- |
| 7 | ヘプト- |
| 8 | 10月- |
| 9 | 非 |
| 10 | 12月- |
仲介者リスト
| 接続タイプ | 仲介者 |
|---|---|
| たった1回の呼び出し | -an- |
| ペア | -en- |
| トリプル | -に- |
| 2つのペア | -dien- |
炭化水素の命名のいくつかの例を見てください。
例:
CH3 – CH2 – CH2 – CH3
上記の構造形式では、単結合のみを持つ4炭素化合物を見ることができます(記号「–」で示されています)。
- 4炭素の接頭辞=しかし-
- シングルバインディングの中間= -an-
- 炭化水素の接尾辞= -o
の和集合を参照してください プレフィックス+中間+サフィックス 名前を生み出す ブタン.
CH2 = CH2
上記の構造形式には、2つの炭素と1つの二重結合があります(「=」記号で示されています)。
- 2つの炭素の接頭辞= et-
- 二重結合の中間体= -en-
- 炭化水素の接尾辞= -o
の和集合を参照してください プレフィックス+中間+サフィックス 名前を生み出す エチレン.
CH2 = CH-CH2 – CH3
CH3 – CH = CH2 – CH3
上記の構造形式は両方とも、4つの炭素と1つの二重結合(「=」記号で示されている)を持っていることに注意してください。
したがって、次のようになります。
- 4炭素の接頭辞=しかし-
- 二重結合の中間体= -en-
- 炭化水素の接尾辞= -o
の和集合を参照してください プレフィックス+中間+サフィックス 名前を生み出すだろう ブテン 2つの構造形態のために。
ただし、構造形式は同一ではないため、命名法も同一ではないことに注意してください。
2つの構造形式の違いは、二重結合の位置にあります。
この場合、ダブルに最も近い端からチェーン内の炭素に番号を付ける必要があります。 したがって、問題のケースでは、左から右に番号を付ける必要があります。
に CH2 = CH-CH2 – CH3:
- CH2 1になります
- CHは2になります
- CH2 3になります
- CH3 4になります
注意してください 二重結合 の間にあります カーボン1 それは カーボン2.
二重結合を見つけるには、最小の数(1)を使用する必要があります。 ブテン-1
に CH3 – CH = CH2 – CH3:
- CH3 1になります
- CHは2になります
- CH2 3になります
- CH3 4になります
二重結合は カーボン2 それは カーボン3.
二重結合を見つけるには、最小の数(2)を使用する必要があります:BUTENE -2
による IUPAC (国際純正応用化学連合 –国際純正応用化学連合)、場所は、 配置されている(上記の構造形式の場合、中間体で表される二重結合 「-en-」)。
これで、利用可能な構造形式の命名法を書く2番目の方法があります。これが最も正しい方法です。
CH2 = CH-CH2 – CH3:BUTENE -1またはBUT-1-ENO(より正確な形式)
CH3 – CH = CH2 – CH3:BUTENE -2またはBUT-2-ENE(より正確な形式)
詳細については IUPAC そして 命名法.

