O 熱 そしてその 熱エネルギー, の違いに動機付けられた 温度, それはより高い温度の体からより低い温度の体に流れます。 異なる温度の物体間のエネルギーの流れは、 熱バランス、熱を交換した物体の温度が等しくなったとき。

たとえ 国際単位系(SI) エネルギーの単位がジュール(J)であり、熱の最も使用される単位がカロリー(cal)であると判断します。 1 カロリー 1gの水が14.5°Cから15.5°Cまで温度変化するのに必要な熱量に相当します。
カロリーとジュールの対応は、1カロリーが約4.18Jに等しいということです。
顕熱
体が特定のものを受け取ったり与えたりするとき 熱量, 温度変化のみを生成することができます、発生せずに 分子の凝集状態の変化、熱は呼ばれます 敏感.
次の式から、物体が受けたり失ったりする顕熱の量を求めることができます。
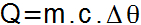
この式では、対応する要素と測定単位は次のとおりです。
Q = 顕熱の量(石灰);
m = 物質の質量(g);
c =比熱 (cal / g°C);
Δθ = 温度変化(°CまたはK)。
2つの観察が重要です:
O 比熱 1gの要素がその温度を1°C上げるのに必要な熱量を決定するのは、各タイプの物質の特徴的な量です。
温度変化は両方で表すことができます °C どのくらいで K、これら2つは はかり 100の間隔があるため、 同じバリエーション.
例
比熱0.5cal / g°Cの特定の物質の4kgのサンプルを、40°Cから50°Cまで加熱するために必要な顕熱の量を決定します。
質問データ:
質量m:m = 4 kg = 4000 g
温度範囲:Δθ= 50 – 40 = 10°C
比熱:c = 0.5cal / g°C
Q =m.c.Δθ
Q = 4000。 0,5. 10
Q = 20,000 cal = 20 kcal
この物質量は、20,000ライムの熱を受けると、10°C変化します。
JoabSilas著
物理学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-calor-sensivel.htm
