本文中「幾何異性体または シス-トランス」は、幾何学的な空間異性または シス-トランス. 簡単に言えば、異性体 シス 各炭素原子上の等しい配位子が同じ平面にある化合物に対応します。 すでに異性体に トランス、 それらは反対側にあります。
これは、ラテン語に由来するこれらの用語の由来によって識別されます。 シス 「隣」を意味し、 トランス 「向こう側」。
この命名法は、2つの炭素がそれぞれ2つの異なる配位子しかない場合に非常に役立ちます。 ただし、これらの用語は、二重結合炭素原子がセット内に3つ以上の異なる配位子を持っているアルケンを指す場合はあいまいになる可能性があります。
たとえば、以下の化合物について考えてみます。

カーボンについては注意してください バツ 最小の原子番号の配位子はCHです3、およびカーボン上 y Hです。 しかし、この化合物が異性体であると言えば シス、次の質問が発生する可能性があります。 彼はどうですか シス 結合基が等しい場合(CH3)反対側にありますか?
したがって、このあいまいさを回避するために、これらの場合、文字Eがドイツ語に由来する命名法E-Zを使用する方が適切です。 entgegen、これは「反対」を意味し、Zはドイツ語から来ています ずさんめん、これは「一緒に」を意味します。 この命名法は、次の規則に従います。

この優先ルールを2-クロロブ-2-エンに適用すると、炭素にそれがあります バツ 原子番号が最も高い配位子はClであり、炭素上にあります y CHです3. したがって、次の異性体があります。
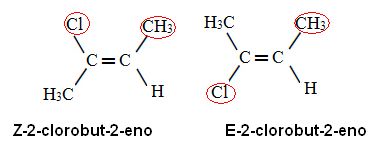
最初のケースでは、原子番号が最も高い配位子が平面の同じ側(Z)にあり、2番目のケースでは反対側(E)にあります。
これは、環状化合物でも発生します。 シスとZ、トランスとEは異なる命名システムであるため、これらの用語を関連付けるのは正しくないことを覚えておくことが重要です。
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/isomeria-e-z-no-lugar-cis-trans.htm

