同じ元素の酸があり、この元素の酸化数(NOX)は同じである可能性がありますが、違いは水和の程度にあります。
たとえば、以下では、リン(P)元素によって形成される3つの酸があります。
H3ほこり4 H4P2O7 HPO3
3つの酸すべてにおいて、リンの酸化数は+5であることに注意してください。 違いは水分補給の程度にあります。
これに基づいて、これらの酸は接頭辞によって命名法で区別されます オルソ、パイロ、メタ.
最も水和した酸はオルトと呼ばれます. 与えられた例では、最初の(H3ほこり4)と呼ばれる 酸 オルソリン酸、それは3つの中で最も水分補給されているからです。 オルト接頭辞は消耗品であるため、ほとんどの場合、この酸は単に呼び出されます リン酸。
接頭辞pyroおよびmetaは、参照点としてオルト酸とともに使用されます。
今やめないで... 広告の後にもっとあります;)
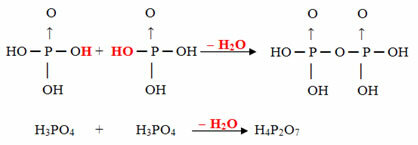
- パイラス:オルト2分子マイナスH1分子2O
例:H4P2O7 と呼ばれる 酸 ピロリン酸 それはオルトリン酸(H3ほこり4)マイナス1水分子。
2. H3ほこり4 = H6P2O8
H6P2O8 -H2O = H4P2O7
このプロセスは 分子間脱水:
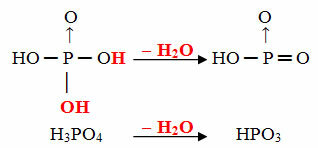
- 目標:1分子のオルトマイナス1分子のH2O
例:HPO3 と呼ばれる 酸 ゴールリン酸 それはオルトリン酸(H3ほこり4)マイナス1水分子。
H3ほこり4 -H2O = HPO3
このプロセスは 分子内脱水:
ジェニファー・フォガサ
化学を卒業
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "酸の水和度"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm. 2021年6月28日にアクセス。
オルトリン酸の分子式は次のとおりです。H3ほこり4. そこから、それぞれピロリン酸とメタリン酸を示す代替マークを付けます。
イオン化度、塩酸、揮発性、酢酸、Svante Arrehenius、酸伝導電気、 中和反応、炭酸塩および重炭酸塩との反応、赤いフェノールフタレイン溶液、リトマス紙 青。