電池 化学エネルギーが自発的に電気エネルギーに変換されるシステムです。
1836年、英国の化学者で気象学者のジョンフレデリックダニエル(1790-1845)は、当時知られているものとは異なる山、アレッサンドロボルタの山を建設しました。 この山で彼は 相互接続された2つの電極は、この金属の陽イオンによって形成された塩の水溶液に浸された金属からなるシステムでした。.
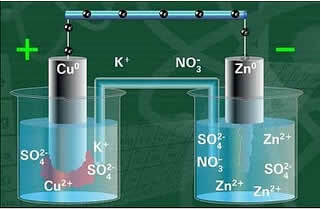
電極の1つである銅電極は、硫酸銅(CuSO4)の溶液に浸した銅板で構成されていました。 もう一方の電極は、硫酸亜鉛(ZnSO4)溶液に浸した亜鉛板からなる亜鉛電極でした。
これらの2つの電極は、ランプを含む電気回路によって相互接続されていました。これは、ランプがオンになると、電流の発生を示すためです。
また、それらの間には塩橋がありました。 このブリッジは、たとえば塩化カリウム(KCl(aq))などの溶解性の高い塩の濃縮水溶液を含むU字型のガラス管で構成されていました。 チューブの端は綿または寒天でコーティングされています。
以下に、ダニエル電池として知られるようになったこのセルまたは電気化学セルの構造を示します。 各電極は半電池と呼ばれることを思い出してください。
回路が閉じていると、ランプが点灯し、しばらくすると、 亜鉛板は腐食して質量が減少しますが、銅板は反対で質量が増加します(下図を参照). また、 Znイオンのmol / L単位の濃度が増加します2+ とCuイオンの減少2+.
ダニエルのスタック概略図。
なんでこんなことが起こっているの?
今やめないで... 広告の後にもっとあります;)
理解するために、各電極で別々に起こる反応を見てみましょう。
亜鉛電極では、次の平衡反応が発生します。
Zn(s)↔Zn2+(ここに) +2および-
これは、(プレートからの)金属亜鉛が酸化を受けることを意味します。つまり、(溶液からの)亜鉛カチオンに2つの電子を供与し、Zn2 +になります。 逆もまた起こり、溶液中に存在する亜鉛カチオンは、亜鉛によって提供された2つの電子を受け取り、金属亜鉛になります。 したがって、酸化と還元の中断のないプロセスがあります。
同じことが銅電極にも当てはまり、動的平衡で全体的な反応が起こります:Cu(s)↔Cu2+(ここに) +2および-
ダニエルは、これら2つの電極を接続すると、反応性の高い電極が、独自の溶液中の陽イオンでこれを行う代わりに、反応性の低い陽イオンに電子を提供することに気付きました。 この場合、亜鉛が最も反応性が高く、酸化を受けて銅に電子を供与するため、その質量が減少します。 酸化を受ける電極は、アノードと呼ばれる負極です。 銅電極は還元を受ける電極であり、銅カチオンは亜鉛から2つの電子を受け取り、カソード(正極)と呼ばれます。
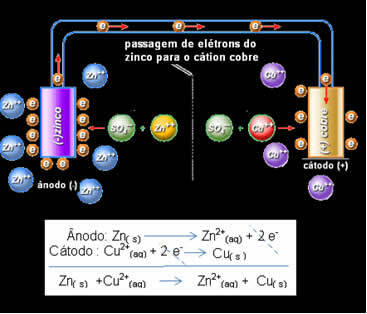
電子通過とダニエルのスタックグローバル方程式。
上に、このスタックのグローバル方程式があります。これは、2つの半反応式を加算することによって得られます。 その表現または化学表記は、次の規則に従って行われます。

したがって、ダニエルのスタックには次のものがあります。
Zn / Zn2+//お尻2+ /お尻
ジェニファー・フォガサ
化学を卒業
ブラジルの学校チーム
物理化学 - 化学 - ブラジルの学校
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "ダニールの山"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. 2021年6月28日にアクセス。

