金属 明るさ、強さ、熱および電気伝導率によって特徴付けられる要素です。 彼らです 事実上すべての工業プロセスに適用可能、 工具、宝飾品、硬貨の製造に使用される金属合金や、レドックスなどの化学プロセスに存在し、 スタック と電池。
周期表では、それらは次のように分類されます。
半金属
遷移金属
アルカリ金属
アルカリ土類金属
鉄鋼業界では、それらは次のように分けられます。
鉄金属
非鉄金属
ヘビーメタル
あまりにも読んでください: 周期表の新しい要素は何ですか?
金属の特性

それらは、ほとんどの場合、熱と電気の優れた伝導体です。
光沢のある外観です。
高い 密度.
それらは電気陽性元素です(それらは陽イオンを形成する傾向があります—正電荷)。
を除いて 水星, それらは、高融点で室温で固体の元素です。
それらは機械的強度(粘り強さ)を持っています。
それらは展性があります(壊れることなく成形することができます)。
今やめないで... 広告の後にもっとあります;)
周期表の金属
アルカリ金属
の要素は 周期表の最初の列、ファミリー1A. それらは、水と混合されると水酸化物、つまりアルカリ性(塩基性)溶液を形成するため、アルカリ金属と呼ばれます。
君は 要素 このグループに属するものは次のとおりです。
リチウム (li)
ナトリウム (で)
カリウム (K)
ルビジウム(Rb)
セシウム(Cs)
フランシウム(Fr)
中性(非荷電/イオン化)状態のアルカリ金属の電子配置は、 最後の殻の電子 (原子価層). O 原子線 そして、これらの金属の反応性は上から下に向かって増加します( 周期表). それらは他の金属と比較して融点が低く、展性があり、密度があまり高くなく、 高い酸化電位.
も参照してください:物質の性質は何ですか?
アルカリ土類金属
これらはに表示される要素です 周期表の2列目、ファミリー2A. と呼ばれる アルカリ土類 19世紀以前は、これらの物質によって形成された酸化物がそのように指定されていたため、基本的な(アルカリ性)特性の溶液を形成する傾向によって、そして地球によって。 この用語は、加熱されたときに突然変異を受けなかった、グループ2元素の一般的な特性である不溶性金属を示すために使用されました。 その後、新しい研究と実験に照らして、「地球」元素が実際には金属によって形成された酸化物であることが発見されました。
それらは可鍛性のある金属であり、密度が低く、 その最外殻の2つの電子は、通常の温度と圧力の条件下で、固体状態で検出されます。 このグループに属する:
ベリリウム (Be)
マグネシウム (Mg)
カルシウム (ここに)
ストロンチウム(Mr)
バリウム (バ)
無線 (カエル)
遷移金属
メイクアップ 周期表のグループB、およびアルカリ土類金属と ametals. それらは、IUPACによって、不完全なenergéticadのエネルギーサブレイヤーを持つ要素として定義されました。 用語 "遷移金属「」とは グループ2から13への移行 周期表と「d」軌道での電子の増加の増加。
遷移金属基は、融点と沸点が高い高密度元素で構成されており、 グループ1および2の金属よりも反応性が低い (ファミリー1Aおよび2A)。 遷移金属の中には、融点(3422°C)が最も高い元素であるタングステンと、水銀(Hg)があります。 は通常の温度と圧力の条件下で液体である金属であり、その融点は(-38.83°C)です。
遷移金属にはさまざまな酸化状態があります(NOX 可変)および着色物質を形成します。

内部遷移元素
内部遷移元素 彼らです:
ランタニド: 57から71の陽子を持ち、プロメチウムを除いて天然の元素で構成されるシリーズ。
アクチニド: 原子番号が89から103の範囲の元素で形成され、ほとんどの場合合成であるグループ。 このグループはすべて 放射性 半減期が短い。
これら2つのグループの元素は融点が高く、すべて室温で固体です。
半金属
君は 半金属 全部で7つの要素があります。
ホウ素(B)
シリコン(Si)
ゲルマニウム(Ge)
ヒ素(As)
アンチモン (月)
テルル(Te)
ポロニウム(Po)
この分類は、 金属および非金属元素に関連するその他の物理化学的特性. 半金属は光沢があり、脆い化合物であり、陽イオンと陰イオン(条件に応じて)を形成することができ、中間導体です。
金属の種類
鉄: 組成に鉄を含む物質。 彼らです 金属合金 一般的な元素として鉄を含みますが、さまざまな濃度で配合することができます 炭素, たとえば、またはさまざまな技術で鍛造されているため、さまざまな物理的特性を持つ製品があります。
非鉄: のような他の種類の金属によって形成された合金 アルミニウム, 銅, ニッケル, 亜鉛, チタン.
ヘビーメタル:鉛、ニッケル、亜鉛、水銀。 それらは反応性、毒性、生体内蓄積性の金属です。 それらは、とりわけ、バッテリー、ランプ、戦争遺物の弾薬に使用されます。
金属の化学結合
金属は 要素 電気陽性つまり、化学結合で電子を失う傾向があります。 金属が非金属と相互作用するとき、それは イオン結合を実行します の違いによる 電気陰性度. 金属の他の結合の可能性は金属結合です。
で 金属接続 金属間で発生し、電子が部分的に放出され、原子の周りに電子の雲または海が形成されます。これにより、金属部品の特性が保証されます 導電率 電気的および順応性。
も参照してください: 導体と絶縁体–違いは何ですか?
金属の入手
ほとんどの金属は自然に見つかります 他の元素に関連する岩石や鉱物. 化合物を分離するための電気分解や化学反応など、金属を精製するためのいくつかの技術があります。
金属の場合、金属のある程度の純度を得るために工業規模で最もよく使用される2つの手法は次のとおりです。 の違い 密度 と磁化率 (金属が反応しなければならない傾向 磁場).

解決された演習
質問1 - (エネム)バッテリーに含まれるカドミウムは、これらの物質が環境中に不規則に廃棄されたり、焼却されたりすると、地面に到達する可能性があります。 金属形態とは異なり、Cd2 +イオンは置換できるため、体にとって非常に危険です。 Ca2 +イオンは、骨に変性疾患を引き起こし、それらを非常に多孔質にし、骨に激しい痛みを引き起こします。 関節。 また、腎臓の機能にとって非常に重要なZn2 +カチオンによって活性化される酵素を阻害することもできます。 この図は、いくつかの金属とそれぞれの陽イオンの半径の変化を示しています。
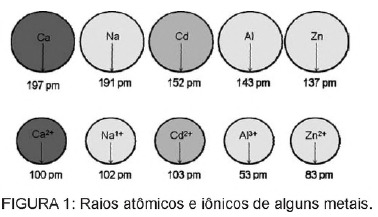
テキストに基づくと、イオン形態のカドミウムの毒性はこの元素の結果です
A)低いイオン化エネルギーを示します。これは、イオンの形成を促進し、他の化合物への結合を促進します。
B)+1から+3の範囲の電荷を持つ金属カチオンによって媒介される生物学的プロセスで作用する傾向があります。
C)生物学的プロセスに作用する金属イオンに比較的近い半径と電荷を持ち、これらのプロセスに干渉を引き起こします。
D)イオン半径が大きいため、通常は小さいイオンが関与する生物学的プロセスに干渉することができます。
E)+2の電荷を持っているため、通常は電荷の低いイオンが関与する生物学的プロセスに干渉することができます。
解決
代替C。 カドミウムは、私たちが自然に体内に持っている金属イオンに似た元素です。 生体内蓄積性であることに加えて、金属基とこの類似性を有するカドミウムは、分子のスルフヒドリル基に結合することができます タンパク質の分解、したがって脱灰、組織および赤血球の破壊などの生物学的プロセスの変化を引き起こします 血液。
質問2 - 金属に関連する特性については、間違った選択肢にチェックマークを付けてください。
A)ほとんどの金属は優れた電気および熱伝導体です。
B)一部の金属は酸化および/または還元を受けやすい。
C)鉄は耐性があり、展性のある金属です。つまり、成形が容易です。
D)アルカリ土類金属は、色が濃いこれらの金属の酸化物を指すこの名前「地球」を持っています。
E)金属は、酸化作用により、さまざまな色の要素であり、くすんでいます。
解決
代替E。 金属は自然に光沢があり、金属の色であり、酸化を受ける可能性があり、それに関連する特性の変化を引き起こします 部品の側面ですが、これはすべての金属で発生する現象ではなく、場合によっては、酸化はいくつかの要因に依存します 外部。
LaysaBernardes著
化学の先生



