THE 生成エンタルピー、 とも呼ばれている 標準生成エンタルピー、または 標準生成熱は、標準状態で、単純な物質から1モルの物質を形成する際に放出または吸収される熱の計算です。
各物質のエンタルピーの絶対値を計算することはできませんが、熱量計を使用して、反応で発生するエンタルピーの変動を計算することはできます。
それを覚えておく必要があります 標準状態の単純な物質にはゼロに等しいエンタルピー値を採用することが合意されました. したがって、物質の生成エンタルピーを知りたい場合は、単純な物質からの生成反応のエンタルピーの値を知るだけで済みます。
たとえば、モル質量が18 g / molであるため、1molに相当する18グラムの水のエンタルピーを求めます。 これを行うには、最初に、以下に示すように、単純な物質から水を形成する反応が必要です。
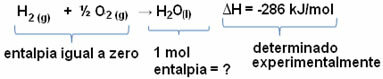
この反応で発生したエンタルピー変化の値は、熱量計を使用して実験的に決定されたものであり、-286 kJ / molに等しいことに注意してください。
このエンタルピー変化(ΔH)を計算する式は次のとおりです。
ΔH= H製品 -H試薬
したがって、ΔHの値はすでにわかっており、反応物のエンタルピーはゼロに等しいことがわかっているので(標準状態では単純な物質であるため)、次のように結論付けることができます。 示されているように、1 molの水のエンタルピー値は、その反応の唯一の生成物であるため、形成反応のエンタルピー変化に等しいこと ベローズ:
ΔH= H製品 -H試薬
-286 kJ / mol = HH2O -(HH2 + H1/2 O2)
-286 kJ / mol = HH2O-0
HH2O = -286 kJ / mol
したがって、このタイプのエンタルピーは、標準状態の単純な物質のエンタルピーから達成されます。 標準生成エンタルピー(ΔH0).
現在、水など、1回の反応では直接生成されない物質がたくさんあります。 このような場合、生成エンタルピーは反応のエンタルピー変動から計算できます。
たとえば、NH4Clは次の反応によって形成されます。
NH3 + HCl→NH4Cl ΔH= -176 kJ / mol
反応物はいずれも単体ではないため、エンタルピーをゼロにすることはできません。 これらは単純な物質間の反応によって形成されるため、各試薬の生成エンタルピーを知る必要があります。
NH3:ΔH= -46 kJ / mol
HCl:ΔH= -92.4 kJ / mol
これらの2つのエンタルピーを合計すると、反応物のエンタルピーの値が得られ、NHのエンタルピーを見つけることができます。4Cl:
HR = HNH3 + HHCl
HR =(-46 +(-92.4)kJ / mol)
HR = -138.4 kJ / mol
式に代入する:
ΔH= H製品 -H試薬
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314.4 kJ / mol
この場合、反応比が1 molしかないため、反応物の生成エンタルピーの値を直接合計しました。 ただし、他の反応でモル数が異なる場合は、最初に反応物の生成エンタルピーにモル数を掛ける必要があります。
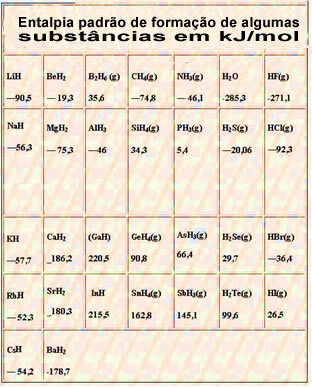
以下は、25°Cおよび1気圧でのいくつかの物質の標準生成エンタルピーの表です。
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm
