THE エンタルピー(H) これは、各材料のエネルギー量またはシステムの全体的なエネルギーとして定義できます。 ただし、実際には、物質のエンタルピーを決定することはできません。 したがって、通常測定されるのは エンタルピー変動 

ここでは、発熱反応(「エキソ」という言葉はギリシャ語に由来し、「アウト、アウト、アウト」を意味します)のエンタルピーの変化を分析します。これは、熱が放出される反応です。 日常生活では、燃焼や生石灰と水との混合など、これらの反応の例がたくさんあります。
これらの場合、エンタルピーの変動 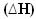 最終エンタルピーから初期エンタルピー(H)を引いた値で与えられる、正確に放出される熱量になります。f -H私)または、反応であるため、生成物のエンタルピー値から反応物のエンタルピー値を引いた値(HP -HR).
最終エンタルピーから初期エンタルピー(H)を引いた値で与えられる、正確に放出される熱量になります。f -H私)または、反応であるため、生成物のエンタルピー値から反応物のエンタルピー値を引いた値(HP -HR).
熱が放出されると、エネルギーが失われます。 したがって、システムの総エネルギーが減少するため、製品のエンタルピーは常に 試薬の数が多いため、発熱反応のエンタルピー変動は常に負になり、 ゼロ 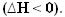
今やめないで... 広告の後にもっとあります;)
一般的な発熱反応を検討する:
| A→B +熱 |
これは、次のようなエンタルピー図を使用して表すことができます。
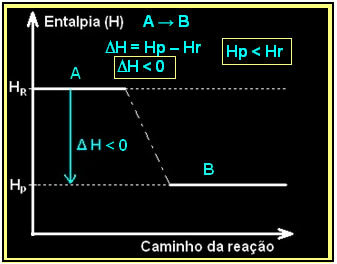
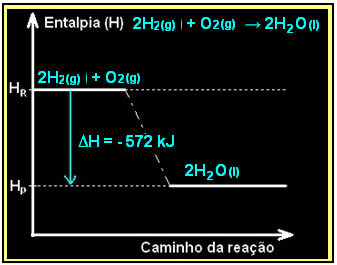
液体の水の形成を伴う水素ガスの燃焼は、エネルギーの放出とともに起こります。 この反応におけるシステムのエンタルピー変動の値は、次の式で与えられます。
2時間2(g) + O2(g) →2H2O(1)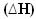 = -572 kJ
= -572 kJ
ダイアグラムは次のように表されます。
ジェニファー・フォガサ
化学を卒業
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "発熱反応におけるエンタルピーの変動"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/variacao-entalpia-reacoes-exotermicas.htm. 2021年6月28日にアクセス。
化学

熱化学、エンタルピー、放出熱、発熱反応、燃焼反応、外部環境、吸熱反応、反応 化学、エネルギー交換、試薬、発光、光吸収、熱、電気、コンポーネント、物理的状態、 製品。