ガスと蒸気
ガスと蒸気の違いは臨界温度から与えられます。 蒸気は気体状態の物質であり、圧力を上げると液化できる状態です。 ガスは同じではありません。 単純な圧力上昇では液化できない流体です。 これにより、ガスは蒸気とは異なります。
ガスの挙動
気体状態の特定の物質は、その温度が臨界温度よりも高い場合、温度が臨界温度以下の場合、その物質は蒸気です。
ヘリウム、窒素、酸素など、私たちが通常知っている実在気体は、それぞれに異なる特定の分子特性を持っています。 しかし、それらをすべて高温高圧に置くと、非常によく似た動作を示し始めます。 気体の研究では、実在気体と同様の振る舞いをする、実際には存在しない単純な理論モデルが採用されています。 この近似は、圧力が低く、温度が高いほど良くなります。 このガスモデルは 完全気体.
17世紀と19世紀頃、3人の科学者(ジャックシャルル、ルイJ. ゲイルサックとポールE。 Clayperon)は、ガスの振る舞いを研究した後、理想気体とも呼ばれる完全ガスの振る舞いを支配する法則を詳しく説明しました。 彼らによって決定された法則は、完全気体の「外部」挙動の規則を確立し、 体積、温度、およびそれらに関連付けられている物理量のみをカウントします。 圧力。
完全気体の一般法則
完全ガスの一般法則を決定する式は、次のように見ることができます。
今やめないで... 広告の後にもっとあります;)
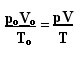
ここでpO、VO およびTO は、それぞれ初期圧力、初期体積、初期温度です。 これは、ガスの変数が変化するときに使用される式です。
ボイルの法則
物理学者で化学者のロバート・ボイルは、ガスの温度が一定に保たれているときに、ガスが受ける変換を支配する法則を決定した人物です。 彼の法則によれば、ガスが等温変換を受けると、その圧力は占有される体積に反比例します。 この法則から、私たちはその方法を取得します TO = T するべき:
POVO = pV
シャルルの法則
シャルルの法則は、完全気体から一定体積への変換を支配する法則です。 これらの変換は、等積変換または等角変換と呼ばれます。 この法則によれば、完全気体の質量が定積変換を受けると、その圧力はその絶対温度に正比例します。 数学的には、この法則は次のように表すことができます。

ここでpO およびTO それぞれ初期圧力と初期温度です。
ゲイ・リュサックの法則
ゲイ・リュサックの法則は、一定の圧力での完全気体の変換を支配する法則です。 この法則は、ゲイ・ルサックという名前が付けられているにもかかわらず、物理学者で化学者のA.C.チャールズによってすでに発見されていました。 法則によれば、ガスが等圧変換を受けると、ガスの体積はその絶対温度に正比例します。 数学的には、この法則は次のように表すことができます。

ここでVO およびTO それぞれ初期体積と初期温度に対応します。
マルクス・アウレリオ・ダ・シルバ
続きを見る!!
ガス変換
ガス変換が何であるかを知っています。
学校や学業でこのテキストを参照しますか? 見てください:
サントス、マルクスアウレリオダシルバ。 "ガスの研究"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. 2021年6月27日にアクセス。



