同素体は、特定の化学元素が異なる単純な物質を形成しなければならないという特性です, つまり、単一のタイプの要素によってのみ形成される物質です。
形成されたさまざまな物質は 形 または 同素体の品種 またはの 同素体.
これらの同素体は、次の2つの主な理由で異なる可能性があります。
1. その張性: 分子を構成する原子の数。
2. 構造: 結晶格子内の原子の配置は、同素体ごとに異なります。
硫黄(S)は、分子を含む最も多様な同素体を持つ元素です。 Sの2、S4、S6そして s8、各分子の原子数が異なります。 これらの硫黄同素体はすべて、444.6°Cから1000°Cの温度の間で、火山噴火を起こしやすい場所で見つけることができます。 ただし、1000°Cを超えると、S2 原子硫黄(S0).
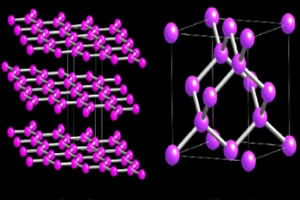
ただし、硫黄の最も重要な同素体は2つです。o 菱形硫黄 それは 単斜晶系硫黄.
どちらも同じ分子式で形成されており、 s8, 2つの違いは、結晶格子内の原子の空間配置にあります。

下の画像でわかるように、菱形の硫黄は黄色で透明な結晶の形をしていますが、単斜晶系の硫黄は針状で不透明です。

今やめないで... 広告の後にもっとあります;)
これらの2つの同素体の硫黄の間で、 菱形が最も一般的です. それは2.07g / cmに等しい密度を持っています3 20°Cで、融点は112.8°Cに等しく、沸点は444.6°Cに等しい。
単斜晶系の密度は1.96g / cmです。3 20ºCで、融点は119ºCに等しく、沸点は菱形硫黄と同じです。 周囲条件下では、どちらも黄色の粉末で、無臭で、水に溶けず、硫化炭素(CS)に非常に溶けます。2).

硫黄にはいくつかの産業用途があり、主な用途は硫酸Hの製造です。2のみ4、これは、さまざまな製品の製造に広く使用されています。 その経済的重要性のために、硫酸の消費はしばしば国の発展の程度を示すことができます。
硫黄のもう1つの重要な用途は、ゴムの加硫です。これは、ゴムに2〜30%の硫黄を添加することです。 加熱し、触媒の存在下で、硫黄が鎖間のブリッジとして機能する三次元ポリマーを形成します 炭酸。 これにより、天然ゴムの耐性と柔軟性が高まり、タイヤの製造などのさまざまな用途に対応できます。
硫黄は、黒色火薬、殺虫剤、化粧品、およびサルファ剤ベースの抗生物質などの医薬品の製造にも使用されます。
*画像の編集クレジット: エムラン/ Shutterstock.com
ジェニファー・フォガサ
化学を卒業
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "硫黄同素体"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/alotropia-enxofre.htm. 2021年6月28日にアクセス。
化学
同素体、単純物質、ガス酸素、オゾン、同素体、化学元素酸素、太陽からの紫外線、ダイヤモンド、グラファイト、原子性、白リンとは何ですか。


