塩酸 イオン化ポテンシャルの高い水和物であり、 黄色がかった液体で、腐食性が高く、毒性があります. 洗浄剤や塩酸塩の製造など、さまざまな工業プロセス、食品、製鋼プロセスで使用されます。
それは人体にも存在します。 O 胃液 の消化に作用します タンパク質 酸性溶液です。 塩酸および他の物質の 酵素 そして 塩. 暴露、吸入または経口摂取 濃塩酸は健康に非常に有害です、死に至ることさえあります。
あまりにも読んでください: 硫酸-腐食性の高い物質
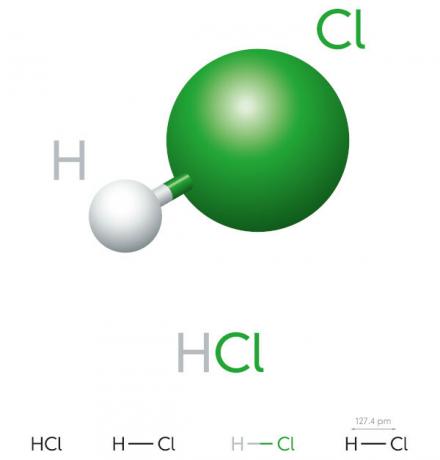
塩酸の性質
- 無機化合物
- 強酸
- 高いイオン化ポテンシャル
- 液体
- 黄色がかった外観
- 毒性
- 腐食性
- 揮発性
- 吸湿性(吸収する傾向がある á水 環境の)
- 水に溶ける
今やめないで... 広告の後にもっとあります;)
塩酸の生産
塩酸は イスラム教徒の錬金術師によって発見された ジャービル・イブネ・ハイアンと呼ばれ、ゲイバーとしても知られ、アラブ化学の父と見なされていました。 彼はに基づいて物質を合成しました 海塩(NaCl)と 硫酸 (で2のみ4).
2NaCl + H2のみ4 →で2のみ4 + 2HCl
現在塩酸 を通じて大規模に生産されています 電子ó溶解 水溶液中の塩化ナトリウムの。 このプロセスから、ガスが得られます 塩素 (Cl2)、ガス 水素 (H2)と 水酸化ナトリウム (NaOH)。 塩素ガスと水素ガスが反応して塩酸を形成します。
Cl2 + H2 →2HCl
しかしながら、 この反応は非常に 発熱 非常に危険です. 現在、工業的に生産されている塩酸のほとんどは有機化合物の生産に関連しており、より経済的で安全なプロセスです。
R-H + Cl2 →R-Cl + HCl
(Rは有機ラジカルであると考えてください。)
も参照してください: 決定するためのヒント-もし 酸の強さ

塩酸の塗布
- 金属酸洗い: 塩酸は、金属を処理する前に「洗浄」するために使用され、表面から錆、スケール、その他の不純物を取り除きます。
- 有機化合物の生産: 塩酸は、プラスチックの製造に使用される塩化ビニルを得るための試薬として使用されます。 塩酸は、合成ゴムに使用されているクロロプレンにも由来します。
- 無機化合物の生産: 塩酸は、試薬や化合物を製造するためのいくつかの工業プロセスに存在します 無機製品には、塩化鉄(III)や塩化鉄(III)などの水処理用製品があります。 アルミニウム。
- 洗浄剤として使用: 塩酸はムリアティック酸としても販売されており、建設後、家庭用、および工具や機械の化学洗浄に使用されます。
- 食品加工: 塩酸は、でんぷんやタンパク質の加水分解など、食品や添加物の製造のためのさまざまな反応、またはpHバランスのための最終製品に使用されます。
- 薬物生産: 塩酸は、ドキシサイクリン塩酸塩などのいくつかの薬に存在する可溶性塩酸塩の製造に使用され、 腸チフス そして 天然痘.
体内の塩酸
塩酸は私たちの中に存在しています 消化器系、私たちの胃によって生成される胃液は、水、酵素、塩酸、無機塩、および少量の乳酸の溶液です。
O フードケーキは粥状液に変わり、 酸性の塊(胃液とその酸性組成物の作用のおかげで)、これは の消化 タンパク質、に変換 ポリペプチド そして アミノ酸 それは体に吸収されます。
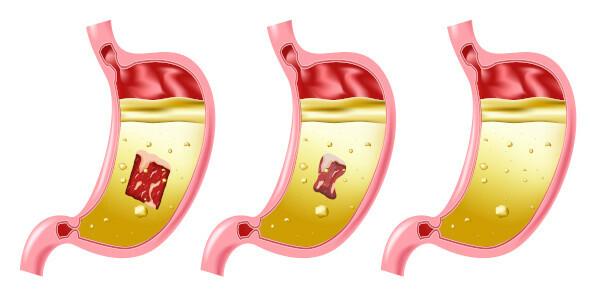
塩酸の危険性
塩酸は非常に強く腐食性の酸であるため、物質との接触はいくつかの損傷を引き起こします。
- 肌:やけどや炎症を引き起こします。
- 目:重度の刺激を引き起こし、失明を引き起こす可能性があります。
- 吸入:上気道に刺激や怪我を引き起こします。
- 摂取:口腔系全体に腐食を引き起こし、胃腸管では、嘔吐、出血、下痢、循環障害を引き起こし、死に至る可能性があります。
- 曝露つづく:最初に粘膜領域を攻撃し、皮膚炎を引き起こし、 結膜炎、歯茎の出血、光増感; 化合物の濃度が低い場合でも、頻繁に吸入すると、 胃炎 と鼻血。
また、アクセス: 酢酸の特性と性質

解決された演習
質問1 - (Udesc)塩酸に関しては、次のように述べることができます。
A)水溶液中の場合、電流を流すことができます。
B)は二酸です。
C)は弱酸です。
D)イオン化度が低い。
E)はイオン性物質です。
解決
代替案A。 塩酸は、イオン化可能なHが1つしかないため、二酸ではありませんが、 強酸、イオン化ポテンシャルの高い分子物質。 THE イオン化 水性媒体中の伝導を促進します 電流 遊離イオンの存在による。
質問2 - 塩酸と水の溶液では、塩化水素分子(HCl)の発生は最小限であると言えます。これは、
A)水と接触している塩酸は希釈されます。
B)塩化水素は水に溶けない物質です。
C)塩化水素はイオン化ポテンシャルが高いため、水性媒体中ではHCl分子がHイオンを形成します。+ Cl-.
D)非常に揮発性の塩酸は溶液から分離し、水分子のみを残します。
E)塩酸はイオン性物質であるため、水溶液中では解離してイオンを形成します。
解決
代替C。
A)答えは質問と一致しません。塩酸を水で希釈しても、HCl分子が存在しないことは正当化されません。
B)不正解ですが、塩化水素は溶解性があり、水に親和性があります。
C)正解
D)塩酸は揮発性ですが、溶液中の2つの種のこの分離はそれほど発生しません。
E)塩酸は塩化水素と水の溶液であり、塩化水素は非イオン性分子物質です。
Laysa Bernardes Marques deAraujo著
化学の先生
学校や学業でこのテキストを参照しますか? 見てください:
ARAúJO、Laysa Bernardes Marquesde。 "塩酸"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm. 2021年6月27日にアクセス。


