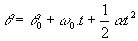אֵנֶרְגִיָהפְּנִימִי הוא הסכום של אנרגיות קינטיות ופוטנציאל הקשור לתנועת האטומים והמולקולות המרכיבות של הגוף. האנרגיה הפנימית גם פרופורציונלית ישירות ל- טֶמפֶּרָטוּרָה של הגוף. זוהי כמות סקלרית הנמדדת בג'ול (SI) ונקבעת כפונקציה של משתנים כגון לַחַץ (P), כרך (V) ו- טֶמפֶּרָטוּרָה תרמודינמיקה (T) של מערכת, בקלווין (K).
ככל שהטמפרטורה של הגוף גבוהה יותר, כך האנרגיה הפנימית שלו גדולה יותר, כך גדלה יכולתו לעשות עבודה כלשהי. יתר על כן, האנרגיה הפנימית של גזים מונו-אטומיים, למשל, ניתנת אך ורק על ידי סכום ה- אנרגיה קינטית מכל אטום הגז. כאשר מתמודדים עם גזים מולקולריים, כגון גזים דיאטומיים, יש לקחת בחשבון אינטראקציות מולקולריות וכן זאת, האנרגיה הפנימית נקבעת על ידי סכום האנרגיה הקינטית של המולקולות עם האנרגיה הפוטנציאלית הקיימת ביניהן הֵם.
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
אנרגיה פנימית של גזים חד-אטומיים אידיאליים
מכיוון שאין אינטראקציה בין האטומים של גז חד-אטומי אידיאלי, האנרגיה הפנימית שלו תלויה אך ורק בשני משתנים: מספר השומות (n) וטמפרטורת הגז (T). שעון:
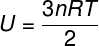
U - אנרגיה פנימית
לא - מספר שומות
ר - קבוע אוניברסלי של גזים מושלמים
ט - טמפרטורה
במשוואה לעיל, ר יש לו מודול של 0.082 atm. L / mol. K או 8.31 J / mol. K (SI). כמו כן, אנו יכולים לכתוב את המשוואה הנ"ל במונחים של כמויות אחרות, כגון לחץ ונפח. לשם כך, עלינו לזכור את המשוואה של קלפיירון, משמש לגזים אידיאליים.
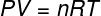
החלפת המשוואה הנ"ל לקודמתה, יהיה לנו הביטוי הבא לחישוב האנרגיה הפנימית:
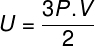
תראהגַם:מהו גז מושלם?
אם ניקח בחשבון את המשוואות לעיל, ניתן לקבוע קשר בין האנרגיה הקינטית של האטומים של גז מונואטומי אידיאלי לטמפרטורה שלו. לשם כך נציין כי האנרגיה הקינטית של סוג גז זה היא אַך וְרַקקינטיקה. שעון:
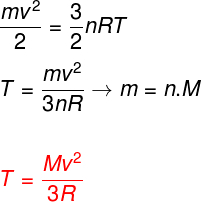
M - פסטה
לא - מספר שומה
M - מסה מולארית
במצבים רבים מעניין לדעת כיצד לחשב את הווריאציה של האנרגיה הפנימית (ΔU) של גז, מכיוון שכמות זו מציינת האם הגז קיבל אוֹ נכנע אֵנֶרְגִיָה. אם הווריאציה של האנרגיה הפנימית של הגז הייתה חיובית (ΔU> 0), הגז יקבל אנרגיה; אחרת (ΔU <0), הגז יוותר על חלק מהאנרגיה שלו.
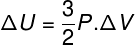
וריאציה של אנרגיה פנימית מבחינת וריאציה של נפח הגז.
אנרגיה פנימית לגזים דיאטומיים
עבור גזים דיאטומיים אידיאליים האנרגיה הפנימית ניתנת על ידי משוואה מעט שונה.
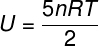
אנרגיה פנימית בתמורות ומחזורים תרמודינמיים
על פי החוק הראשון של התרמודינמיקה, האנרגיה הפנימית של גז אידיאלי עשויה להשתנות באופן מסוים טרנספורמציות תרמודינמיות, תלוי בכמות החום המוחלפת בין הסביבה למערכת, כמו גם העבודה שבוצעה על ידי המערכת או על המערכת.
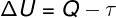
ש - חום
τ - עבודה
לאחר מכן, בואו נסתכל על הצורה של החוק הזה להתממשויות תרמודינמיות מסוימות.
תראהגַם:היסטוריה של מכונות תרמיות
→ אנרגיה פנימית: טרנספורמציה איזותרמית
בְּ טרנספורמציה איזותרמית, אין שינוי בטמפרטורה ולכן האנרגיה הפנימית נשארת קבועה.
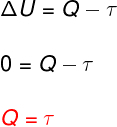
במקרה זה, כל כמות החום המוחלפת עם המערכת הופכת לעבודה ולהיפך.
→ אנרגיה פנימית: טרנספורמציה איזובולומטרית
בְּ טרנספורמציה איזובולומטרית, לא ניתן לבצע עבודות מכיוון שהמערכת מוגבלת במיכל נוקשה ולא ניתן להרחבה. במקרה זה, כל כמות החום המוחלפת עם המערכת משתנה באופן ישיר את האנרגיה הפנימית שלה.
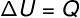
→ אנרגיה פנימית: טרנספורמציה איזוברית
בסוג זה של טרנספורמציה המערכת נתונה לא לחץ מתמידלכן ניתן לחשב את העבודה שנעשתה על ידו או עליו.
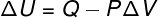
→ אנרגיה פנימית: טרנספורמציה אדיאבטית
בתוך ה טרנספורמציות אדיאבטיות, אין חילופי חום בין המערכת וסביבתה, ולכן, שונות האנרגיה הפנימית תלויה אך ורק בעבודה שמבצעת המערכת או במערכת.
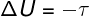
אנרגיה פנימית בתהליכים מחזוריים
בכל תהליך מחזורי, המצב התרמודינמי של המערכת, המיוצג על ידי משתני הלחץ, הנפח והטמפרטורה שלה (P, V, T), הוא הופך, אך בסופו של דבר חוזר למצב המקורי (P, V, T), ולכן וריאציית האנרגיה הפנימית בסוג זה של תהליך היא תמיד אפסית = 0).
תראהגַם:טרנספורמציות מחזוריות
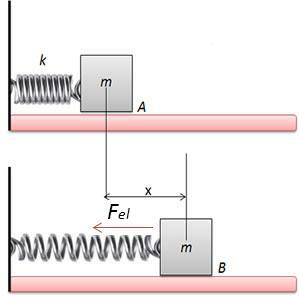
עיין בתרשים שלמטה, המציג שלוש טרנספורמציות תרמודינמיות מובחנות בין מצבים A ו- B.
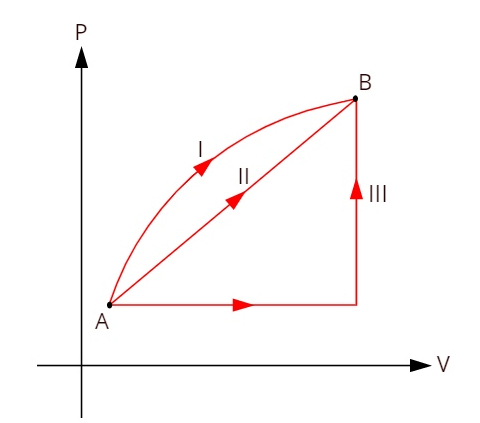
כאשר שלושת הטרנספורמציות (I, II ו- III) עוזבות את המצב A ועוברות למצב B, וריאציית האנרגיה הפנימית חייבת להיות שווה לכולן, ולכן:
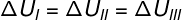
תרגילי אנרגיה פנימיים
1) שתי שומות של גז דיאטומי אידיאלי, בעלות מסה טוחנת השווה ל -24 גרם למול, נמצאות בטמפרטורה של 500 K בתוך מיכל סגור וקשיח בנפח השווה ל -10-3 m³. לקבוע:
א) המודול של האנרגיה הפנימית של גז זה בג'אול.
ב) הלחץ שמפעיל הגז על קירות המכולה.
פתרון הבעיה:
ה) מכיוון שמדובר בגז אידיאלי ודיאטומי, נשתמש בנוסחה להלן כדי לחשב את האנרגיה הפנימית שלו:
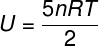
אם ניקח את הנתונים שהתבשרו בהצהרת התרגיל, יהיה עלינו לפתור את החישוב הבא:
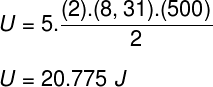
ב) אנו יכולים לקבוע את הלחץ שהגז מפעיל ברגע שנדע את נפח המכל שלו: 10-3 m³. לשם כך נשתמש בנוסחה הבאה:
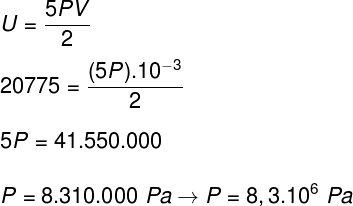
על ידי רפאל הלרברוק