אחד פתרון חיץ היא תערובת המשמשת למניעת שינוי ה- pH או ה- POH של המדיום כאשר מוסיפים חומצות חזקות או בסיסים חזקים.
ישנם שני סוגים של פתרון חיץ:
1. תערובת של חומצה חלשה עם בסיסה המצומד;
2. תערובת של בסיס חלש עם חומצת הצמידה שלו.
בואו נסתכל על דוגמאות של כל אחד וכיצד הוא עובד כאשר מוסיפים כמות קטנה של חומצה או בסיס חזק למדיום:
1. תערובת של חומצה חלשה עם בסיסה המצומד:
ליצירת תמיסה כזו מערבבים את החומצה החלשה עם מלח באותו אניון כמו החומצה.
לדוגמה, שקול פתרון חיץ המורכב מחומצה אצטית (H3CCOOH(פה)) ונתרן אצטט (H3CCOONa(ים)). ראה שלשניהם יש את האניון של האצטט: (H3CCOO-(פה)). ריכוז היונים הללו נובע כמעט מהניתוק של המלח, שהוא גדול. יינון החומצה קטן.

עכשיו שים לב מה קורה באפשרויות התוספת הבאות:
- תוספת של כמות קטנה של חומצה חזקה:
תוספת של חומצה חזקה מעלה את ריכוז יון ההידרוניום, H3או+1ומכיוון שחומצה אצטית היא חומצה חלשה, יש לאניון האצטט זיקה גבוהה לפרוטון (H+) הידרוניום. באופן זה הם מגיבים ונוצרת חומצה אצטית יותר:

כתוצאה מכך, ה- pH של המדיום כמעט ולא משתנה. עם זאת, אם יתווספו עוד ועוד חומצה חזקה, יגיע הזמן בו כל אניון האצטט ייצרך ואפקט החוצץ ייפסק.
- תוספת של כמות קטנה של בסיס חזק:
תוספת של בסיס חזק מגדילה את ריכוז יוני OH-. אך יונים אלה מנוטרלים על ידי יוני H3או+1 משוחרר ביינון של חומצה אצטית:

עם תגובה זו, ריכוז יוני H3או+1(פה) יקטן ויהיה שינוי בשיווי המשקל במובן של הגברת יינון החומצה, ולכן וריאציית ה- pH של התמיסה תהיה קטנה מאוד. ריכוז יוני H3או+1(פה) זה יהיה כמעט קבוע.
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
במקרה זה קיימת גם יכולת הגבלת גבול. לכן, אם נוסיף עוד ועוד בסיס, איזון יינון החומצה יועבר יותר ויותר לעבר יינון שלו, עד שכל החומצה תצרך.
2. תערובת של בסיס חלש עם חומצת הצמידה שלו:
סוג זה של תמיסת חיץ מורכב מבסיס חלש ומתמיסת מלח המכילים קטיון זהה לבסיס.
לדוגמה, שקול פתרון חיץ שנוצר על ידי מגנזיום הידרוקסיד, MgOH2 (aq) (בסיס חלש) ומגנזיום כלורי, MgCl2 (ים) (מלח). שניהם מכילים את הקטיון מגנזיום (מג2+(פה)). יונים המגנזיום הקיימים במדיום נגזרים כמעט כולם מניתוק המלח, מכיוון שהניתוק של הבסיס חלש:
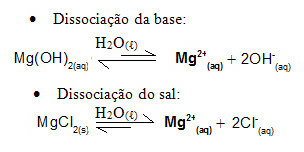
- תוספת של כמות קטנה של חומצה חזקה:
במקרה זה, יוני ה- H3או+1 המגיע מתוספת חומצה חזקה ינוטרל על ידי יונים OH-, שמקורו בדיסוציאציה חלשה מבסיס. זה יעביר את איזון הניתוק הבסיסי ימינה.
לפיכך, וריאציית ה- pH (אם קיימת) תהיה קטנה מאוד מכיוון שריכוז יוני ה- OH- נשאר קבוע. אפקט החוצץ יפסיק כאשר הבסיס כולו יתנתק.
- תוספת של כמות קטנה של בסיס חזק:
הבסיס החזק הנוסף עובר דיסוציאציה ומשחרר יונים של OH-. מכיוון שמגנזיום הידרוקסיד הוא בסיס חלש, למגנזיום המשתחרר על ידי ניתוק מהמלח יש נטייה גדולה יותר להגיב עם ה- OH-:

לכן, הגידול ביוני OH- מתקזזת מעלייה פרופורציונאלית ב- Mg (OH)2 (aq). כתוצאה מכך, ה- pH אינו עובר שינויים גדולים.
השפעה זו מסתיימת כאשר כל קטיון המגנזיום נצרך.
מאת ג'ניפר פוגאצה
בוגר כימיה
האם תרצה להתייחס לטקסט זה בבית ספר או בעבודה אקדמית? תראה:
FOGAÇA, ג'ניפר רושה ורגס. "מהו פתרון חיץ?"; בית ספר ברזיל. אפשר להשיג ב: https://brasilescola.uol.com.br/quimica/o-que-uma-solucao-tampao.htm. גישה אליו ב -28 ביוני 2021.
כִּימִיָה

בדוק את הידע שלך ולמד עוד ברשימה זו של תרגילים נפתרים על איזונים כימיים. באמצעות חומר זה תוכלו להבין טוב יותר כיצד לעבוד על קבועי שיווי משקל (Kp, Kc ו- Ki), שינוי שיווי משקל, pH ו- pOH, כמו גם שיווי משקל במה שמכונה פתרונות חיץ.
פיתרון, פיתרון מוצק. תמיסה נוזלית, תמיסה גזית, תמיסות שנוצרו על ידי גז ונוזל, תמיסות שנוצרו על ידי נוזלים.