הידרוגנציה מתרחשת עם פחמימנים אציקליים בלתי-רוויים, כלומר בעלי שרשראות פתוחות עם קשרים כפולים או משולשים, כגון אלקנים, אלקינים ודינים. זה יכול להתרחש גם בפחמימנים ארומטיים, מכיוון שיש להם קשרים כפולים בזירה, ועם ציקלנים (ציקלואלקנים) של עד חמישה פחמנים.
תרכובות אלה מגיבות כמו גז מימן בנוכחות זרז כלשהו, כגון ניקל, פלטינה ופלדיום, בחימום. לפיכך, מתרחשת תגובת תוספת, בה נשבר הקשר pi (π) ויוצר שני קשרים בודדים חדשים ומימן מוחדר למולקולה.
באופן כללי, יש לנו:
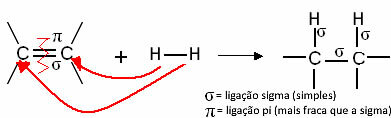
תגובת הידרוגנציה כללית
בואו נסתכל על כמה דוגמאות:
- הידרוגנציה לאלקנים: המוצר המתקבל הוא אלקן.
להלן יש לנו תגובת הידרוגנציה של אתילן (או אתילן) להשגת אתאן:
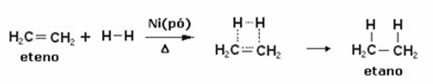
דוגמא לתגובת מימן אתילן
סוג זה של הידרוגנציה קטליטית משמש את תעשיית המזון לייצור שומנים חצי מוצקים כגון מרגרינות. שמנים ושומנים צמחיים נבדלים רק בכך ששמנים הם בעלי מולקולות ארוכות עם קשרים כפולים בין פחמנים, בעוד שלשומנים יש קשר יחיד בלבד ביניהם פחמנים.
לפיכך, כדי להמיר שמן לשומן, זה מספיק כדי לייצב את השמן. כך האג"ח הכפולות שלך יישברו ויומרו לאג"ח יחיד. התוצאה היא הפקת שיחות שומנים צמחיים מוקשים.
- הידרוגנציה של אלקין: מכיוון שלאלקינים יש שני קשרי pi, ההיווצרות המוחלטת שלהם מתקיימת בשני שלבים, בראשונה נוצר אלקן ובשני אלקן.
בתגובה למטה יש לנו הידרוגנציה של פרופין עם היווצרות סופית של פרופאן:
שלב ראשון: ה3C C ≡ CH + ה2 → H3C Cה═ Çה2
שלב שני: ה3C Cה═ Çה2 + שעתיים2 → H3C Cה2─ Çה3
אם אנו רוצים שתגובה זו תיפסק בשלב הראשון, עלינו להשתמש בחומר כלשהו שיעצור את פעולת הזרז.
- הידרוגנציה של דינים: ישנם שלושה סוגים של דינים: צָבוּר (קשרים כפולים מופיעים למטה), מְבוּדָד (קשרים כפולים מופרדים על ידי שני קשרים בודדים לפחות) ו- מצומדות (קשרים כפולים מופיעים לסירוגין).
הידרוגנציה של דיאנים מצטברים ומבודדים מתרחשת באותו אופן שראינו עבור אלקנים, אך כפול, שכן לדיאנים יש יותר בלתי רוויה. ראה שתי דוגמאות:
* דוגמה להידרוגציה בדין מצטבר:
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
ח ח ה
│ │ │
ה3C CH ═ Ç ═ CH ─ CH3 + שעתיים2 → H3C CH ─ Ç ─ CH ─ CH3
│ │ │
ח ח ה
* דוגמה להידרוגנציה בדיאן מבודד:
H H H H
│ │ │ │
ה3C CH ═ CH─CH2 ─ CH ═ CH ─ CH3 +2 ח2 → H3C CH ─ CH─CH2 ─ CH ─ CH ─ CH3
מצד שני, הידרוגנציה של דינים מצומדות יכולה לקרות בשתי דרכים: עם תוספת 1.2 ו -1.4 תוספת. הנפוץ ביותר הוא תוספת 1,2, בה מוסיפים מימנים לפחמנים היוצרים את הקשר הכפול ובטמפרטורות נמוכות. התוספת 1,4, לעומת זאת, מתרחשת בטמפרטורות גבוהות והיא כאשר יש תהודה ומראה של ערכים חופשיים בפחמנים 1 ו -4. ראה דוגמאות לכל מקרה:
* דוגמה לתוספת 1.2 בדינים מצומדות:
ה2C CH ─ CH ═ CH2 + ה2 → H2C CH ─ C ─ CH CH2
│ │
H H
* דוגמה לתוספת 1.4 ב dienes מצומדות:
ה2C CH ─ CH ═ CH2 + ה2 → H2C CH ═ CH CH2
│ │
H H
- הידרוגנציה של ארומטים: קשרי ה- pi של טבעת הבנזן נשברים ואטומי המימן מתווספים לפחמנים שיוצרים קשרים אלה.
סוג זה של הידרוגנציה מוחלטת מוצג להלן:

תגובה מוחלטת של מימן בנזן
- מימן מחזורי: נוצר היווצרות של אלקן.
דוגמה: הידרוגנציה של ציקלופרופן:
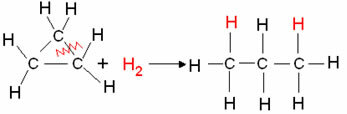
תגובת הידרוגנציה של סיקלופרופאן
מאת ג'ניפר פוגאצה
בוגר כימיה
האם תרצה להתייחס לטקסט זה בבית ספר או בעבודה אקדמית? תראה:
FOGAÇA, ג'ניפר רושה ורגס. "תגובת הידרוגנציה אורגנית"; בית ספר ברזיל. אפשר להשיג ב: https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm. גישה אליו ב -28 ביוני 2021.
סקרנות

איך הגיעה המרגרינה?, מרגרינה, היסטוריה של הופעתה של המרגרינה, פרס שזכה בהיפולייט דה מורג מוריס בשנת 1869, הפרס שהוצע על ידי ממשלת נפוליאון, בתקופה בה צרפת עברה משבר כלכלי חמור, כמה חשיפות