בתוך הטקסט "אלקטרוליזה דלקתית”, הוסבר כי תהליך זה מתרחש כאשר זרם חשמלי מועבר בחומר מותך (במצב נוזלי), ללא נוכחות של מים ובדרך זו הקטיון מקבל אלקטרונים והאניון תורם אלקטרונים, כך שלשניהם יש מטען חשמלי השווה לאפס ואנרגיה צָבוּר.
כדי להבין טוב יותר כיצד מתרחשת אלקטרוליזה דלקתית, בואו ניקח בחשבון את אחת הדוגמאות החשובות ביותר לתהליך מסוג זה, אלקטרוליזה של נתרן כלורי או מלח שולחן (NaCl).
נתרן כלורי נוצר בטבע באמצעות העברת אלקטרון מנתרן (Na) לכלור (Cl), לפי התגובה שלהלן:
2Na (ים) + 1Cl2(ז) → 2NaCl (ים)

תהליך זה הוא ספונטני, אך התהליך ההפוך של תגובה זו אינו ספונטני, כלומר ייצור גז כלור (Cl2(ז) - איור למטה) ונתרן מתכתי (נא (ים)) אינו מופיע בטבע. אם נרצה שזה יקרה, נצטרך להתחיל בתהליך.
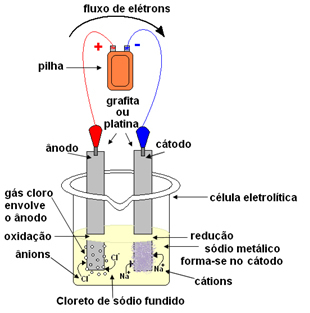
ניתן לעשות זאת באמצעות אלקטרוליזה דלקתית. המלח מחומם לטמפרטורה מעל 800.4 מעלות צלזיוס, שזו נקודת ההתכה שלו; ובדרך זו הוא מתמזג, עובר ממוצק לנוזל. במצב פיזי זה, יוני ה- Na שלך+ וקל- בחינם.
המלח המותך מונח לאחר מכן במיכל, הכלי האלקטרוליטי ושתי אלקטרודות פלטינה או גרפיט אינרטיות טובלות בנתרן הכלורי. אלקטרודות אלה מחוברות למקור שמייצר זרם חשמלי ישיר, כמו סוללה או תא.
עם מעבר הזרם החשמלי, קורה הדברים הבאים:
- הקוטב השלילי של הסוללה או התא מספק אלקטרונים לאחת האלקטרודות, שהופכת לקתודה;
- קָטוֹדָה: מקבל את האלקטרונים מהתא והופך לקוטב השלילי, מושך את קטיוני ה- Na+, כי מטענים הפוכים מושכים. יונים אלה מקבלים את האלקטרונים מהאלקטרודה (קתודה) והפחתתם מתרחשת ויוצרים נתרן מתכתי:
צִמצוּם:בְּ+(ℓ) + ו- → ב(ים)
נתרן מתכתי מופקד על גבי האלקטרודה ונשלח למאגר.
- אָנוֹדָה: הופך להיות טעון חיובי, מושך אניוני Cl- (לכן זה נקרא אנודה). יונים אלה מאבדים את האלקטרונים שלהם כאשר הם באים במגע עם האנודה, ולכן הם עוברים חמצון ויוצרים אטומי כלור, המשלבים מיד שניים לשניים ליצירת גז כלור:
חִמצוּן:2Cl-(ℓ) → 2 ו-- + 1Cl2(ז)
גז זה מבעבע סביב האנודה ונאסף על ידי צינור זכוכית המותאם למערכת.
לפיכך, התגובה הכוללת המתרחשת במקרה זה ניתנת על ידי:
קתודה: 2 נא+(ℓ) + 2e- → 2Na(ים)
אנודה: 2Cl-(ℓ) → 2 ו-- + 1Cl2(ז) ____________
תגובה עולמית: 2Na+(ℓ) + 2Cl-(ℓ) → 2Na(ים) + 1Cl2(ז)
היבט חשוב נוסף שיש לשים לב אליו, שהודגש בסוף הטקסט המוזכר (אלקטרוליזה דלקתית), הוא כי לצורך אלקטרוליזה מתרחשת, התא או הסוללה המשמשים להפקת הזרם החשמלי חייבים להיות בעלי ddp (הפרש פוטנציאל) השווה או גדול מההפרש הפוטנציאלי של תְגוּבָה.
בואו נסתכל על זה במקרה של אלקטרוליזת נתרן כלורי שאנחנו שוקלים. כדי לגלות את ההבדל הפוטנציאלי של תגובה זו, מספיק להקטין את פוטנציאל ההפחתה הסטנדרטי של הקתודה בזה של האנודה. זה מוסבר בטקסט. הבדל פוטנציאלי של סוללה .
דרך הטבלה של פוטנציאל הפחתה סטנדרטי (E0אדום), אנו יודעים כי:
בְּ+(ℓ) + ו- → ב(ים) AND0אדום = -2.71
2Cl-(ℓ) → 2 ו-- + 1Cl2(ז) AND0אדום = +1.36
עכשיו פשוט הקטינו את הערכים הללו כדי לדעת את ההבדל הפוטנציאלי של התגובה הגלובלית:
∆ואנד0 = AND0אדום (קתודה) וגם0אדום (אנודה)
∆ואנד0 = -2,71 – (+ 1,36)
∆ואנד0 = - 4.07 וולט
לכן, המשמעות היא שהתא או הסוללה שישמשו חייבים להיות במתח שווה או גדול מ- 4.07V בכדי לבצע אלקטרוליזה דלקתית של נתרן כלורי.
הערך השלילי רק מציין שמדובר בתהליך לא ספונטני.. במקרה של סוללות, שזה תהליך ספונטני, ערך הכוח האלקטרומטיבי (∆E0) תמיד נותן חיובי.
מאת ג'ניפר פוגאצה
בוגר כימיה
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/quimica/eletrolise-Ignea-cloreto-sodio.htm

