תאים, או תאים אלקטרוכימיים וסוללות הם מכשירים שבהם אנרגיה כימית הופכת באופן ספונטני לאנרגיה חשמלית.התא מורכב משתי אלקטרודות בלבד ואלקטרוליט, ואילו הסוללה היא סט סוללות בסדרה או במקביל.
בְּ סוללות ראשוניות הן מכשירים שאינם נטענים, היות שכאשר התגובה להפחתת החמצון המתרחשת בתוכם נפסקת, יש להשליך אותם.
עבור כל ציוד מצוין סוג של סוללה ובין הסוללות העיקריות המשמשות כיום העיקריות הן: תאים יבשים של לקנשה (סוללות נפוצות או תאי חומצה), סוללות אלקליין וסוללות ליתיום / מנגן דו חמצני.
ראה מה מייחד אותם ולאיזה ציוד הם מתאימים:
- תאים יבשים לקלאנשה:
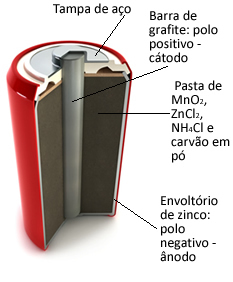
כלונסאות אלה נוצרות בעצם על ידי מעטפת אבץ, המופרדת על ידי נייר נקבובי ובר גרפיט מרכזי המוקף דו חמצני מנגן2), אבקת פחם (C) ומשחה רטובה המכילה אמוניום כלורי (NH4Cl), אבץ כלורי (ZnCl2) ומים (ח2O).
או אָבָץ עובד כמו אָנוֹדָה, אובדן אלקטרונים; זה ה גרָפִיט עובד כמו קָטוֹדָה, מוליך אלקטרונים לדו תחמוצת המנגן:
תגובת חצי אנודה: Zn (ים) → Zn2+(פה) + 2 ו-
חצי תגובה של קטודה: 2 MnO2 (aq) + 2 NH41+(פה) + 2e- → 1 Mn2או3(ים) + 2NH3 (ז) + שעה2או(1)
תגובה עולמית: Zn (ים) + 2 MnO2 (aq) + 2 NH41+(פה) → Zn2+(פה) + 1 מיליון2או3 (ים) + 2NH3 (ז)
סוג זה של סוללה מתאים לציוד הדורש פריקה קלה ורציפה, כמו שלט רחוק, שעון קיר, רדיו נייד וצעצועים.
תוכל לקבל פרטים נוספים על מקורם, תפקודם, עמידותם, ddp, הסכנות ואמצעי הזהירות שיש לנקוט בסוללות אלה בטקסט "מחסנית יבשה לקלאנשה”.
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
- סוללות אלקליין:
פעולתו דומה מאוד לזו של תאים יבשים של לקנשה, אולם ההבדל היחיד הוא במקום של כלוריד אמוניום (שהוא מלח חומצי), מוסיפים בסיס חזק, בעיקר נתרן הידרוקסיד (NaOH) או אשלגן הידרוקסיד (KOH).
תגובת חצי אנודה: Zn + 2 OH → ZnO + H2O + 2e-
חצי תגובה של קטודה: 2 MnO2 + H2O + 2e-→ Mn2או3 + 2 אוה
תגובה כוללת: Zn +2 MnO2→ ZnO + Mn 2או3

סוללות אלקליין מועילות יותר מאלה חומציות במובן שיש להן עמידות רבה יותר, בתוך בדרך כלל מספקים 50-100% יותר כוח מסוללה רגילה באותו גודל, ובנוסף יש פחות סכנה דליפות.
הם מיועדים בעיקר למכשירים הדורשים הורדות מהירות ואינטנסיביות יותר, כמו מכשירי רדיו, נגני CD / DVD ו- MP3 ניידים, פנסים, מצלמות דיגיטליות וכו '.
קרא גם את הטקסט סוללות אלקליין.
- סוללות ליתיום / מנגן דו חמצני:
סוללות אלה הן קלות משקל ומייצרות מתח גדול (כ -3.4 וולט) ולכן הן משמשות לעתים קרובות בציוד קטן כמו שעונים ומחשבונים. שלא כמו המקרים הקודמים, הפורמט שלו הוא מטבע, כפי שמוצג בתמונה הבאה:

האנודה היא ליתיום, הקתודה היא דו תחמוצת המנגן והאלקטרוליט הוא תמיסת מלח:
תגובת חצי אנודה: לקרוא →לקרוא+ + ו−
תגובה חציונית לקתודה: MnO2 + לקרוא+ + ו−→MnO2(li)
תגובה כוללת: Li + MnO2 → MnO2(li)
מאת ג'ניפר פוגאצה
בוגר כימיה
האם תרצה להתייחס לטקסט זה בבית ספר או בעבודה אקדמית? תראה:
FOGAÇA, ג'ניפר רושה ורגס. "הסוגים הנפוצים ביותר של תאים וסוללות ראשוניות"; בית ספר ברזיל. אפשר להשיג ב: https://brasilescola.uol.com.br/quimica/tipos-pilhas-baterias-primarias-mais-comuns.htm. גישה אליו ב -27 ביוני 2021.
