איזומרים פעילים או איזומרים פעילים אופטית (IOA) הם מולקולות של חומר כימי מסוים שיכולות לבצע את הקיטוב והסטייה של תוכנית של אוֹר ימין או שמאל. כדי לבדוק האם לחומר יש איזומרים פעילים, בדוק אם יש פחמן אסימטרי בנוסחה המבנית שלו:

ניתוח השרשרת המיוצגת בתמונה לעיל, אנו יכולים לראות כי ה- לפחמן המרכזי יש ארבעה ליגנדים שונים (OH, H, CH3 ו- Cl), מה שהופך אותו ל- פַּחמָן אסימטרי, המכונה גם פחמן כיראלי. לפיכך, בכל פעם שיש בשרשרת פחמן כיראלי אחד או יותר, יהיו איזומרים פעילים.
אתה סוגים של איזומרים פעילים(IOA) הם:
ימני: איזומר אופטי פעיל המרכין ימינה אור מקוטב;
לבוגירו: איזומר אופטי פעיל המכופף אור מקוטב שמאלה.
תַצְפִּית: נוכחות של פחמן אסימטרי בנוסחה מבנית מצביעה על כך שהחומר חייב להיות בעל האיזומר המיטיב והאיזומר הקשור לסיבוב. לא עלינו לדעת באיזו דרך הוסט האור, מכיוון שנוכחות הפחמן הכיראלי כבר מעידה על עובדה זו. תמיד מחצית מהמולקולות הקיימות הן שמאליות והחצי השני ימני.
מולקולות שמאליות וימניות ימניות של כל חומר אורגני תמיד יש את אותן תכונות פיזיקליות (נקודה של התכה, נקודת רתיחה, צפיפות, מסיסות וכו '), אך קיימות פעילויות כימיות (התנהגות באורגניזם) הרבה הבדלים. דוגמה לכך היא אדרנלין. רק מולקולת אדרנלין מוטציה פועלת בגוף, ואילו מולקולת דה-טרוטורציה אינה פועלת.
ראה כעת את הנוסחה המבנית של חומר הבוטן -2-ol כדי לבדוק אם יש לו איזומרים פעילים או לא:
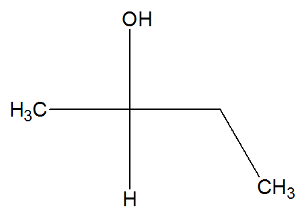
אנו יכולים לראות, במבנה של בוטן -2-אול, שיש לפחמן 2 ארבעה קלסרים שונים (OH, H, CH3, CH2-CH3), אז זה פחמן כיראלי ו מציג איזומר פעיל dextrorotatory ועוד איזומר פעיל levorotary.
חישוב איזומרים פעילים (IOA)
הכימאי ההולנדי יעקובוס הנריקוס ואן הוף פיתחה נוסחה המאפשרת חישוב כמה איזומרים פעילים (IOA) יכול חומר מסוים להציג. תראה:
IOA: 2לא
n: הוא מספר הפחמנים הכיראליים בנוסחת המבנה של החומר.
עקוב אחר שתי דוגמאות ליישום נוסחת Vant't Hoff:
5-דיכלורו-2,3-דיהידרוקסי-חומצה הקסאנדיאית

בנוסחה המבנית של המתחם ישנם שלושה פחמנים כיראליים או אסימטרי, לכן:
IOA = 2לא
IOA = 23
IOA = 8
2,3,4,5-טטרהידרוקסי הקסאנל

בנוסחה המבנית של המתחם ישנם ארבעה פחמנים כיראליים (חצים אדומים) או אסימטרי, לכן:
IOA = 2לא
IOA = 24
IOA = 16
תַצְפִּית: קיימת האפשרות כי בנוסחה מבנית יש שני פחמנים אסימטריים בעלי ליגנדים זהים לחלוטין. אם זה קורה, אנו מחשיבים בחישובים רק 1 לערך n, ולא 2. ראה דוגמה:
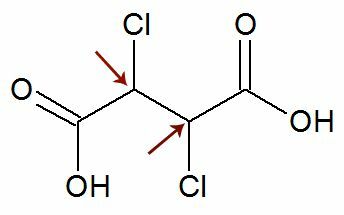
כמו שני פחמנים כיראליים הם שווים, אנו רואים רק אחד פחמן בחישוב:
IOA = 2לא
IOA = 21
IOA = 2
על ידי. דיוגו לופס דיאס
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm

