יש לנו ערבוב של תמיסות עם מומסים שונים ללא תגובה כימית כששתי תערובות או יותר שיש להן חומרים עם אותו יון במשותף (אותו קטיון או אותו אניון). כמו בדוגמה שלהלן:
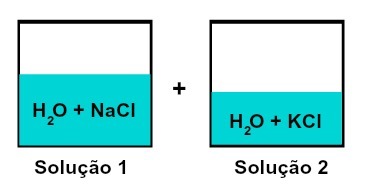
תערובת של פתרונות בעלי מומסים שונים
פתרון 1 הוא מים ונתרן כלורי (NaCl), ואילו בתמיסה 2 יש מים ואשלגן כלורי (KCl). כשמערבבים יחד יש לנו ערבוב של תמיסות מומס שונות ללא תגובה כימית, מכיוון ששני המלחים המשמשים הם בעלי האניון הכלורי (Cאני-).
1- מאפיינים של תערובות של תמיסות מומס שונות ללא תגובה כימית
כאשר מתבצעת תערובת של תמיסות עם מומסים שונים ללא תגובה כימית, המאפיינים שלהלן נבדקים תמיד:
המסה של כל אחד מהמומסים אינה משתנה (אם בתמיסה 1 יש לנו 10 גרם מומס וב -2, 30 גרם, למשל, לאחר הערבוב תהיה לנו אותה המסה של כל מומס),
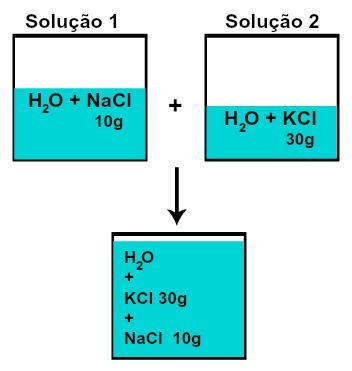
המסה של כל אחד מהמומסים לאחר ערבוב תמיסות ללא תגובה כימית
ה כמות חומר (n) מכל אחד מהמומסים לא משתנה (אם בתמיסה 1 יש לנו 5 מולקולות של מומס וב -2, 4 מול, למשל, לאחר הערבוב תהיה לנו אותה כמות של חומר לכל אחד),
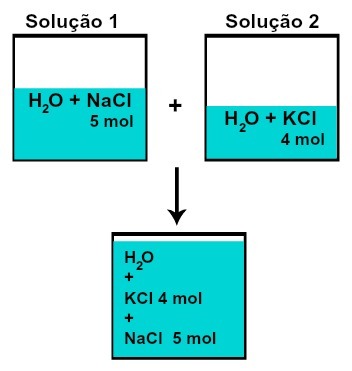
מספר השומות של כל אחד מהמומסים לאחר ערבוב תמיסות ללא תגובה כימית
נפח הפתרון הסופי, V.F, היא תוצאה של סכום הנפחים של כל אחד מהפתרונות המעורבים (אם בתמיסה 1 יש לנו 200 מ"ל ובפתרון 2, 300 מ"ל, למשל, לאחר הערבוב יהיה לנו 500 מ"ל נפח),
וF = V.1 + V.2
2- נוסחאות המשמשות לחישובים של תמיסות ערבוב של מומסים שונים ללא תגובה כימית.
כמו בסוג זה של תערובת יש לנו רק עלייה בכמות הממיסים ביחס לכל אחת מהן מומסים, עלינו לחשב את הריכוז הסופי של כל אחד מהמומסים באמצעות הדברים הבאים ביטויים:
א) ל ריכוז משותף (Ç)
לפתרון 1: הכפל של ריכוז תמיסה 1 בנפחו שווה לריכוז הסופי כפול נפחו
Ç1.V1 = גF.VF
לפיתרון 2: הכפל של ריכוז הפתרון 2 בנפחו שווה לריכוז הסופי כפול נפחו
Ç2.V2 = גF.VF
ב) ל ריכוז בכמות החומר או הטוחנות (M)
לפתרון 1:
M1.V1 = MF.VF
לפיתרון 2:
M2.V2 = MF.VF
ג) ריכוז בכמות החומר של כל יון הקיים בתמיסה
אם עלינו לקבוע את הריכוז של אחד או כל היונים הקיימים בתמיסה הסופית, עלינו:
1º: זכרו שריכוז היונים ניתן על ידי הכפלת הריכוז (M), של המומס ממנו הוא בא, על ידי האינדקס שלו בנוסחת החומר. אז לגבי היון Y, בחומר 1, XY3, הריכוז יהיה:
[Y]1 = 3. M
באשר למומס 2, ZY, הריכוז של Y יינתן על ידי:
[Y]2 = 1. M
2º: אם יש לנו יותר ממומס אחד שמשחרר את אותו יון, למשל, המומסים XY3 ו- ZY, שיש להם אותו יון Y, הריכוז של יון זה בתמיסה הסופית ניתן על ידי סכום הריכוזים שלו לכל מומס:
[Y]F = [Y]1 + [Y]2
3- דוגמאות לחישובים הכוללים פתרונות ערבוב של מומסים שונים ללא תגובה כימית
דוגמה 1: (PUC SP) בכוס, 200 מ"ל של תמיסה מימית של סידן כלורי (CaCl) היו מעורבים2) של ריכוז 0.5 מול. ל–1 ו -300 מ"ל של תמיסה 0.8 מול. ל–1 של נתרן כלורי (NaCl). לתמיסה המתקבלת ריכוז אניון כלורי הוא בערך:
א) 0.34 מול. ל–1
ב) 0.65 מול. ל–1
ג) 0.68 מול. ל–1
ד) 0.88 מול. ל–1
ה) 1.3 מול. ל–1
הנתונים שמסרו התרגיל היו:
פתרון 1:
נפח (V.1): 200 מ"ל
ריכוז טוחנת (M1): 0.5 מול. ל–1
פתרון 2:
נפח (V.2): 300 מ"ל
ריכוז טוחנת (M2): 0.8 מול. ל–1
לקביעת ריכוז אניוני הכלוריד (Cl-), עלינו לבצע את השלבים הבאים:
שלב 1: לחשב את נפח הפתרון הסופי
וF = V.1 + V.2
וF = 200 + 300
וF = 500 מ"ל
שלב 2: חשב את הריכוז הטוחני של התמיסה הסופית ביחס למומס CaCl2, באמצעות הביטוי למטה:
M1.V1 = MF.VF
0.5,200 = MF.500
100 = MF.500
100 = MF
500
MF = 0.2 מול. ל–1
שלב 3: חשב את ריכוז הטוחנת של כלוריד [Cl-]1, בפתרון הסופי, ממומס CaCl2, באמצעות הביטוי למטה:
הערה: בנוסחה יש לנו את הכפל של מולריות ב- 2 כי יש לנו אינדקס 2 ב- Cl, בנוסחה המומסת CaCl2.
[קל-]1 = 2. מ 'F
[קל-]1 = 2. 0,2
[קל-]1 = 0.4 מול. ל–1
שלב 4: חשב את הריכוז הטוחני של התמיסה הסופית ביחס למומס NaCl, באמצעות הביטוי להלן:
M2.V2 = MF.VF
0.8,300 = MF.500
240 = MF.500
240 = MF
500
MF = 0.48 מול. ל–1
שלב 5: חשב את ריכוז הטוחנת של כלוריד, [Cl-]2, בתמיסה הסופית, ממומס NaCl, תוך שימוש בביטוי להלן:
הערה: בנוסחה יש לנו כפל מולריות ב- 1 כי יש לנו אינדקס 1 ב- Cl, בנוסחה של NaCl המומס.
[קל-]2 = 1. M.F
[קל-]2 = 1. 0,48
[קל-]2 = 0.48 מול. ל–1
שלב 6: חשב את הכמות הכוללת של יוני כלוריד בתמיסה הסופית
לשם כך, פשוט הוסף את הריכוזים הטוחניים של כלורידים לכל אחד מהמומסים בשלבים 3 ו -5:
[קל-]F = [קל-]1+ [Cl-]2
[קל-]F = 0,4 + 0,48
[קל-]F = 0.88 מול. ל–1
דוגמה 2: לתמיסה של 500 מ"ל של 6 mol / L KOH נוספו 300 מ"ל של תמיסת K.2רק3 3 mol / L. מה הריכוז של כל אחד מהמומסים בתערובת המתקבלת
א) 3.75 ו -3.0 מול / ליטר
ב) 3.75 ו- 1.215 mol / L
ג) 4.5 ו- 1.125 mol / L
ד) 3.75 ו- 1.125 מול / ליטר
ה) 4.5 ו- 1.215 mol / L
הנתונים שמסרו התרגיל היו:
פתרון 1:
נפח (V.1): 500 מ"ל
ריכוז טוחנת (M1): 6 mol. ל–1
פתרון 2:
נפח (V.2): 300 מ"ל
ריכוז טוחנת (M2): 3 mol. ל–1
לקביעת ריכוז אניוני הכלוריד (Cl-), עלינו לבצע את השלבים הבאים:
שלב 1: לחשב את נפח הפתרון הסופי
וF = V.1 + V.2
וF = 500 + 300
וF = 800 מ"ל
שלב 2: חשב את הריכוז הטוחני של התמיסה הסופית ביחס למומס KOH, באמצעות הביטוי להלן:
M1.V1 = MF.VF
6,500 = מ 'F.800
3000 = MF.800
3000 = MF
800
MF = 3.75 מול. ל–1
שלב 3: חשב את הריכוז הטוחני של התמיסה הסופית ביחס למומס K2רק3, באמצעות הביטוי למטה:
M2.V2 = MF.VF
3,300 = MF.800
900 = MF.800
900 = MF
800
MF = 1.125 mol. ל–1
על ידי. דיוגו לופס דיאס
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-solutos-diferentes-sem-reacao-quimica.htm
