בחיי היומיום ובמעבדות, יש תגובות ושינויים שהם ספונטניים ואחרים שאינם ספונטניים. לדוגמא, כל הבעירה היא תגובה ספונטנית, מכיוון שברגע שהיא מתחילה, היא תמשיך עד שכל הדלק ייצרך או עד שכל החמצן ייעלם.
מצד שני, אלקטרוליזה היא תהליך לא ספונטני, שבו אנרגיה חשמלית הופכת לאנרגיה כימית. דוגמה לכך היא אלקטרוליזה של נתרן כלורי (NaCl). כאשר מועבר זרם חשמלי מעל המלח המותך הזה, יש תגובות חיזור ויצירת נתרן מתכתי (Na(ים)) וגז כלור (Cl2 (גרם)). אם נפסיק להפעיל את הזרם החשמלי, התגובה לא תמשיך בכוחות עצמה, מה שמראה שהוא לא ספונטני.
ניתן למדוד את הספונטניות של תגובה באמצעות ה- משוואת גיבס-הלמהולץ, המפורטים להלן:

על מה:
∆G = וריאציה של אנרגיה חופשית;
∆H = שינוי אנטלפיה;
T = טמפרטורה בקלווין (תמיד חיובי);
∆S = שינוי אנטרופיה.
משוואה זו תופסת את שמה מכיוון שהציעה אותה הפיזיקאי האמריקאי י. וילארד גיבס (1839-1903) ועל ידי הפיזיקאי הגרמני הרמן הלמהולץ (1821-1894).
כדי להבין טוב יותר כיצד משוואה זו מסייעת לנו לקבוע את הספונטניות של תגובה, בואו נסקור בקצרה את כל המושגים המעורבים בה:
- ∆H (וריאציה לאנטלפיה): אנתלפיה (H) היא תכולת האנרגיה של חומר. עד כה לא ידועה שום דרך לקבוע זאת. בפועל, מה שמושג הוא למדוד את וריאציית האנטלפיה (∆H) של תהליך, באמצעות קלורימטרים. וריאציה זו היא כמות ה אנרגיה ששוחררה או נקלטה בתהליך.
- ∆S (וריאציה אנטרופיה):אנטרופיה (S) היא הכמות התרמודינמית המודדת את מידת ההפרעה במערכת.
לדוגמא, בהמסת קרח, מולקולות עוברות ממצב מוצק למצב נוזלי, שם יש חוסר ארגון גדול יותר. המשמעות היא שבתהליך זה האנטרופיה גדלה (∆S> 0).
בייצור אמוניה (NH3), 1 מול של גז חנקן מגיב עם 3 מול של גז מימן (כלומר, 4 מול של מולקולות בתגובות), מה שמוליד 2 מול אמוניה:
נ2 (גרם) +3 ח2 (גרם) → 2 NH3 (ז)
מכיוון שמספר המולקולות בשלב הגז פוחת בתהליך זה, חוסר הארגון פחת, מה שאומר שגם האנטרופיה פחתה (∆S <0).
- ∆G (אנרגיה חופשית): אנרגיה חופשית או גיבס אנרגיה חופשית (מכיוון שהוצע על ידי מדען זה רק בשנת 1878) הוא האנרגיה השימושית של המערכת המשמשת לעבודה.
למערכת יש אנרגיה גלובלית, אך רק חלק קטן מהאנרגיה תשמש לעבודה, זה נקרא אנרגיה חופשית של גיבס, המסומלת על ידי ז.
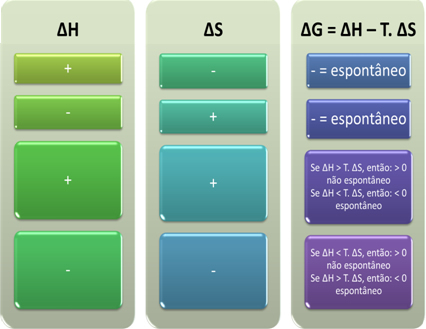
לדברי גיבס, תהליך נחשב ספונטני אם הוא מבצע עבודה, כלומר אם G פוחת. במקרה זה, המצב הסופי של השינוי יהיה יציב יותר מהמצב הראשוני כאשר ∆G <0.
על סמך זה אנו יכולים להסיק את הדברים הבאים:

אנו יכולים גם לראות אם תהליך יהיה ספונטני על ידי התבוננות בסימן האלגברי של ∆H ו- ∆S במשוואת גיבס-הלמהולץ:
מאת ג'ניפר פוגאצה
בוגר כימיה
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm
