בדרך כלל התגובות של אלקטרוליזה מימית ו אלקטרוליזה דלקתית הם מבוצעים באמצעות אלקטרודות גרפיט ופלטינה, שאינן משתתפות בתגובה; הם מוליכים רק זרם חשמלי. עם זאת, ישנם מקרים ספציפיים שבהם יש צורך להשתמש בהם אלקטרודות פעילותכלומר עוברים הפחתה וחמצון.
מקרי השימוש העיקריים של אלקטרודות אלה המשתתפים בתהליך החמצון הם: א טיהור מתכות אלקטרוליטי, כגון אבץ, קובלט, ניקל ובעיקר נחושת; וגם את גלוון. בואו נראה כיצד כל מקרה מתרחש:
• טיהור אלקטרוליטי נחושת: זיקוק נחושת אלקטרוליטי זה יכול לייצר טוהר של כ 99.9% ומשמש בעיקר לייצור חוטי נחושת אשר, אם הם בעלי כמות הטומאה הנמוכה ביותר, עשויים להיות בעלי יכולתם להוביל זרם חשמלי מאוד מְמוּעָט.
שים לב כיצד מתרחש תהליך זה, לראות את התרשים של בור אלקטרוליטי המורכב להלן:

הבדל פוטנציאלי מוחל על התמיסה המימית נחושת סולפטית (CuSo4 (aq)) - שמוליך חשמל - כך שהאנודה, שהיא נחושת מטאלית טמאה, מאבדת אלקטרונים, כלומר עוברת חמצון ומשחררת את הקטיונים שלה (Cu2+), המופקדים על הלוח השלילי. זו יכולה להיות צלחת פלטינה אינרטית, או, יותר טוב, צלחת נחושת טהורה. הוא מהווה את הקתודה, המופחתת ככל שמופקד בה נחושת. לפיכך, התגובות למחצה המתרחשות באלקטרודות הן:
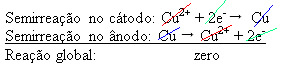
העובדה שהוא נתן תוצאה אפסית מצביעה על כך שלא הייתה שום תגובה כימית, אלא רק הובלת נחושת. בתחתית המיכל נמצאים החומרים הטמאים האחרים שהיו בנחושת כמו זהב, כסף, סיליקה (חול) ומינרלים אחרים, שאפשר אפילו למכור.
• גלוון: ציפוי מתכתי מוחל על חומר שיש להגן מפני קורוזיה.
המתכת שנבחרה לציפוי - שיכולה להיות כרום (ציפוי כרום), ניקל (ציפוי ניקל), כסף (ציפוי כסף), זהב (מוזהב) או אבץ (גלוון) - תהיה האלקטרודה החיובית האנודה, שעוברת חמצון, מאבדת אלקטרונים. הוא עובר חמצון במקום החומר שהוגן, מכיוון שפוטנציאל ההפחתה שלו גדול יותר.
האלקטרודה השלילית, כלומר הקתודה, שמקבלת את האלקטרונים הללו ועוברת צמצום, היא החומר עצמו שכוסה. באופן זה, הוא נשאר מוגן גם אם משטחיו מופר איכשהו.
מאת ג'ניפר פוגאצה
בוגר כימיה
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm
