קרבונטים הם תרכובות אנאורגניות שנוצרו על ידי קישור יוני של מתכת או חצי מתכת עם האניון הפחמתי, CO32-.
פחמן הוא רב-ערכי, כלומר יש לו ארבעה אלקטרונים במעטפת הערכיות והוא יכול ליצור ארבעה קשרים קוולנטיים כדי להיות יציבים, בעוד שחמצן הוא דו-ערכי, בעל שישה אלקטרונים בקליפת הערכיות ויכול ליצור שני קשרים כדי להיות יציבים, עם שמונה אלקטרונים. לפיכך, יש נטייה חזקה לפחמן להיקשר לשני אטומי חמצן, שכולם יציבים (O ═ C ═ O → שיתוף2).
אך חמצן אחר יכול להשתלב בפחמן, מכיוון שיחס הרדיוסים היוניים מוביל למספר תיאום השווה ל -3 ויוצר מבנה משולש שבו הפחמן נמצא במרכז, יוצר קשר כפול עם אחד מאטומי החמצן ושני קשרים בודדים עם שני האחרים חמצן. התוצאה היא שני אלקטרונים עודפים, מכיוון ששני החמצן הללו אינם יציבים, והם זקוקים לקבלת אלקטרון אחד כל אחד:
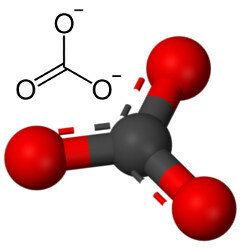
האניון הפחמתי נוצר על ידי קשרים קוולנטיים, אך תרכובותיו, שהן מלחים ומינרלים אנאורגניים המכונים פחמתי, הם יוניים, שכן רדיקל זה מקבל שני אלקטרונים ממתכת כלשהי או מתכת למחצה, ויוצרים a קשר יוני.
תרכובות אלו אינן מסיסות במים, למעט אמוניום פחמתי ((NH4)2שיתוף3) ופחמתי שנוצרו עם מתכות אלקליות (יסודות ממשפחה 1:
Li, Na, K, Rb, Cs ו- Fr). כמעט כולם מוצקים לבנים, כפי שמוצג בתמונה למטה:
שתי הדוגמאות היומיומיות הנפוצות והחשובות ביותר לפחמתי הן נתרן פחמתי (Na2שיתוף3) וסידן פחמתי (CaCO3). במקרה הראשון, נתרן שייך למשפחה 1, בעל אלקטרון בקליפת הערכיות ונוטה לאבד את האלקטרון הזה כדי להיות יציב. מכיוון שאניון הפחמתי צריך לקבל שני אלקטרונים, הוא נקשר לשני אטומי נתרן:

אפר סודה ידוע יותר בשם סודה או סודה, ומשמש לייצור סבונים, צבעים, תרופות, נייר ובטיפול במי בריכה. אבל היישום העיקרי שלו הוא עם סידן פחמתי וחול בייצור זכוכית.
סידן הוא משפחה 2, בעל נטייה לאבד שני אלקטרונים. לפיכך, אטום סידן נקשר לרדיקל פחמתי:

סידן פחמתי קיים באבן גיר ובשיש. בְּ נטיפים וזקיפים שקיימות במערות מורכבות מפחמן זה; קליפות, שוניות אלמוגים וקליפות ביצים. כאשר אנו מטייחים קירות, גזעי עצים ומקומות אחרים, אנו משתמשים בסידן הידרוקסיד (Ca (OH))2), אשר לאורך זמן מגיב עם פחמן דו חמצני אטמוספרי ליצירת סידן פחמתי.

קרבונטים נפוצים מאוד על פני כדור הארץ, כמו במקרה של מינרלים. הסריגים הגבישיים שלהם יכולים לארגן את עצמם בחלל בשני אופנים: האורטורומביים (כמו במקרה של המינרל אראגוניט המוצג לעיל יחד עם נוסחת הסידן הפחמתי) מעוין או טריגונלי, כמו במקרה של קלציט (מינרל נוסף המורכב מסידן פחמתי).
קרבונטים מגיבים בנוכחות חומצות, ומשחררים CO2, שנראה בקלות דרך התפשטות.
מאת ג'ניפר פוגאצה
בוגר כימיה

