ה מְסִיסוּתניתן להגדיר כ הכמות המרבית האפשרית של מומס שניתן להמיס בכמות מסוימת של ממס בטמפרטורה נתונה.
כמות מקסימלית זו שניתן להמיס ידועה גם בשם מקדם מסיסות אוֹ דרגת מסיסות. אבל מסיסותו של כל חומר תלויה, בין היתר, בסוג הממס שבו מפוזר המומס.
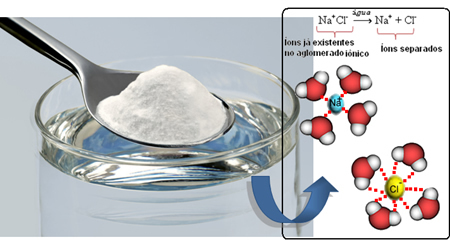
לדוגמה, NaCl (נתרן כלורי - מלח שולחן) מסיס מאוד במים, וב-1 ליטר מים ב-20ºC, אנו יכולים להמיס עד 360 גרם של מלח זה. אך כאשר הממס משתנה לבנזין, באותם תנאים של נפח, טמפרטורה ולחץ, המלח אינו מתמוסס.
מדוע מסיסותו של חומר משתנה כל כך מממס אחד למשנהו?
אחד הגורמים הוא ה קוטביות מהתרכובות המעורבות. בדוגמה שצוטטת, יש לנו ש- מלח הוא קוטבי, מים קוטבי, ובנזין אינו קוטבי. מלח נוצר על ידי אטומים של נתרן (Na) וכלור (Cl) הנקשרים דרך קשרים יוניים, שבהם נתרן בהחלט תורם אלקטרון לכלור ויוצר יוני Na+ ו-Cl-. מכיוון שיונים אלה יש מטענים הפוכים, הם מושכים ומחזיקים יחד (Na+Cl-).

זה מראה לנו שמלח הוא באמת קוטבי, כל קשר יוני הוא קוטבי, מכיוון שיש הבדל במטען החשמלי בתרכובת.
במקרה של מים, הקשר הקיים הוא קוולנטי, שבו שני אטומי מימן חולקים אלקטרונים עם אטום חמצן. למולקולת המים יש שני דיפולים, כאשר חמצן בעל מטען שלילי חלקי ומימן בעל מטען חיובי חלקי (δ
- O ─ H δ+). אבל, דיפולים אלה אינם מבטלים זה את זה, מכיוון שמולקולת המים נפגשת בזווית של 104.5º, מה שמראה שההפצה והמטען לאורך המולקולה אינם אחידים. יש צפיפות מטען שלילית גדולה יותר על אטום החמצן של המולקולה. זה מראה לנו שמולקולת המים היא באמת קוטבית.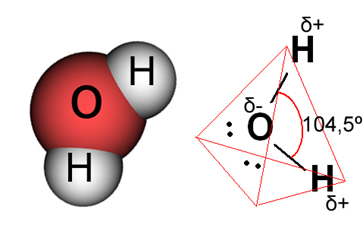
אז כשאנחנו מערבבים את המלח למים, החלק החיובי של המלח, שהוא קטיוני ה-Na.+, נמשך על ידי החלק השלילי של המים, שהוא חמצן, והחלק השלילי של המלח (Cl anions-) נמשך על ידי החלק החיובי של המים (H+). כתוצאה מכך, האיגוד Na+Cl- הוא מתפרק, וממיס את המלח במים.
בנזין, לעומת זאת, נוצר מתערובת של פחמימנים שונים, שאינם קוטביים, כלומר, חלוקת המטען החשמלי של הבנזין היא אחידה. לפיכך, אין אינטראקציה של יוני המלח עם בנזין והוא אינו מתמוסס.
מקרים אלו ואחרים דומים מובילים אותנו למסקנה הבאה:

עם זאת, זה לא יכול להיחשב כלל כללי, שכן ישנם מקרים רבים של מומסים לא קוטביים שמתמוססים היטב בממסים קוטביים ולהיפך. לכן, כדי להבין מדוע זה קורה, עלינו לשקול גורם נוסף: סוג של כוח בין מולקולרי של הממס והמומס.
חוק על כך בטקסט: "קשר בין חוזק בין-מולקולרי למסיסות של חומרים”.
מאת ג'ניפר פוגאסה
בוגר לימודי כימיה
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm
