Kp הוא ראשי התיבות המשמשים לקביעת קבוע של שיווי משקל מבחינת לחצים חלקיים. הקבוע הזה עובד עם ערכי המשתתפים הגזים של שיווי משקל ביחידת האטם, למשל.

משוואה המייצגת תגובה כימית עם רכיבים גזים
במשוואה זו, כל המשתתפים הם גזים, כך שכאשר לגז משתתף יש א לחץ חלקי בתערובת, הוא מיוצג על ידי הקיצור pX.
בעת הגדרת משוואת שיווי המשקל הכימי (במונחי ריכוז), יש למקם את התוצרים במונה ולמקם את המגיבים במכנה:
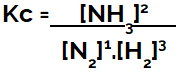
ביטוי Kc של שיווי משקל היווצרות אמוניה
הביטוי של קבוע שיווי משקל במונחים של לחץ (Kp) עוקב אחר הדפוס של Kcכלומר, הלחצים החלקיים של הריאגנטים ממוקמים במכנה והלחצים החלקיים של המוצרים במונה:
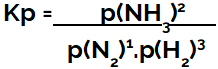
ביטוי Kp של שיווי משקל ביצירת אמוניה
תַצְפִּית: אם משוואת התגובה של ה איזון כימי אל תציג אף משתתף גזי, זה לא יוצג אוטומטית Kp.
דוגמה: (PUC-MG) לתגובה: 2 CO(ז) + O2(g)? 2 CO2(g), הלחצים החלקיים של CO(ז) זה ה2(g) בשיווי משקל הם, בהתאמה, 0.2 atm ו-0.4 atm. לחץ המערכת הכולל הוא 1.4 אטמוספירה. הערך של Kp שכן התגובה היא:
א) 56.2
ב) 40.0
ג) 35.6
ד) 28.4
ה) 25.6
הנתונים שמספק התרגיל הם:
לחץ חלקי פחמן חד חמצני (pCO) = 0.2 atm;
לחץ חלקי של פחמן חד חמצני (pO2) = 0.4 atm;
לחץ כולל = 1.4 atm;
כדי לקבוע את ה-Kp של מערכת זו, עלינו לבצע את השלבים הבאים:
שלב ראשון: קבע את הלחץ החלקי של פחמן חד חמצני (pCO2).
לשם כך, רק זכור שהלחץ הכולל (pt) הוא סכום כל הלחצים החלקיים:
pt = pCO + pCO2 + pO2
1.4 = 0.2 + p (CO2) + 0,4
1.4 - 0.2 - 0.4 = pCO2
pCO2 = 0.8 atm
שלב שני: קבע את Kp של התרגיל.
לשם כך, פשוט השתמש בערכים בביטוי של קבוע שיווי המשקל Kp:
Kp = (pCO2)2
(pCO)2.(אָבָק2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
מאתי דיוגו לופס דיאס
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm

