Kps הוא ראשי התיבות המשמשים לייצוג ה- מוצר מסיסות קבוע, המתייחס למוצר (הכפל) של ריכוזים בכמות החומר מהיונים הנמצאים בתמיסה.
בכל פעם שמתווסס ממס כגון מומס מסיס גרוע כמות קטנה של חלק ממלח זה מתמוסס במים, והשאר מצטבר בתחתית המיכל ויוצר את גופו של רקע כללי. המלח הנמס סובל דיסוציאציה, משחרר קטיונים ואניונים למים.

משקעים נוכחים בתמיסה עם מים ובריום סולפט
חוץ מזה המלח אינו מציג טוב מְסִיסוּת, כמות המומס המומס אינה משתנה לאורך זמן מכיוון שקיים שיווי משקל של פירוק בין יוני המלח (הקיים בתמיסה) לבין גוף הרקע.

מאזן פירוק של BaSO4 במים
Kps של מומס
או Kps של מומס הוא תוצר הריכוזים הטוחניים של היונים המשתתפים. תמיד יש צורך להעלות את ריכוז היונים למקדם הסטואיכיומטרי בהתאמה (משמש לאיזון המשוואה).

שיווי משקל של פירוק אלקטרוליט Yהאיקסב
או Kps של שיווי המשקל המוצע למלח Yהאיקסב יהיה בו ריכוז ריאגנט Y (מורם למקדם הסטואיכיומטרי שלו (a) וריכוז המוצר X (מועלה למקדם הסטוייכומטרי שלו (b)).
Kps = [Y+ ב]ה.[איקס-ה]ב
דוגמא
נניח שאנחנו מכינים פתרון עם ציאניד מים ואלומיניום [Al (CN)3], שהוא מלח בלתי מסיס כמעט במים. כאשר מלח זה מתווסף למים, בסופו של דבר הוא סובל מתופעת דיסוציאציה.

שיווי משקל של פירוק אלקטרוליטים (CN)3
לכן, דרך משוואת שיווי המשקל של פירוק המלח, יש לנו את זה Kps יהיה הכפלת ריכוז קטיון האלומיניום (Al+3) הועלה למעריך 1 על ידי ריכוז האניון של ציאניד (CN-1) הועלה למעריך 3.
Kps = [אל+3]1[CN-1]3
משמעויות Kps של מומס
כאשר אנו מוצאים את Kps של מלח מסוים מעורבב עם מים, אנו יודעים גם את הריכוז של כל אחד מהיונים בתמיסה. בעזרת נתונים אלה אנו יכולים לקבוע את דירוג הפתרון או את התנהגות המומס בתמיסה. שקול את האיזון הבא:

שיווי משקל של פירוק אלקטרוליט Yהאיקסב
אנו יכולים ליצור את מערכות היחסים הבאות:
אם Kps = [Y+ ב]ה.[איקס-ה]ב = 0, יש לנו תמיסה רוויה ללא נוכחות של משקעים;
אם Kps> [Y+ ב]ה.[איקס-ה]ב = 0, יש לנו תמיסה בלתי רוויה, כלומר כמות נמוכה של מומס מומסת בממיס (ביחס ל מקדם מסיסות);
אם Kps + ב]ה.[איקס-ה]ב = 0, יש לנו תמיסה רוויה עם גוף תחתון, כלומר תהיה משקעים של האלקטרוליט (המומס);
אם ערך Kps של האלקטרוליט נמוך מדי, זהו חומר מסיס גרוע בממיס.
דוגמא של חישוב Kps של מומס
(UERN): המסיסות של סידן חנקתי [Ca (NO3)2] במים הוא 2.0. 10–3 מול / ליטר בטמפרטורה מסוימת. ה- Kps של המלח הזה באותה טמפרטורה הוא:
א) 8.10–8.
ב) 8.10–10.
ג) 3.2.10–10
ד) 3.2.10–8
נתוני התרגיל:
פורמולת המלח: Ca (NO3)2;
ריכוז מלח טוחן (מסיסות): 2.0. 10–3 פְּרוּצָה.
כדי לפתור ולחשב Kps, עליך לבצע את הפעולות הבאות:
שלב 1: הגדר את מאזן פירוק המלח.
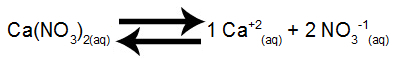
שיווי משקל של פירוק חנקן סידן במים
סידן חנקתי, כאשר הוא עובר דיסוציאציה במים, משחרר 1 שומה של קטיוני סידן (Ca+2) ו- 2 mol של אניונים חנקתי (NO3-1).
שלב 2: הרכיב את הביטוי של ה- Kps של המלח
ה- Kps של המלח הזה יהיה תוצר של ריכוז קטיון הקטיון שהועלה למעריך 1 על ידי ריכוז האניון החנקתי שהועלה למעריך 2, כמוצג להלן:
Kps = [Ca+2]1.[ב3-1]2
שלב 3: קבע את ערכי ריכוזי היונים בתמיסה
כדי לחשב את ה- Kps, אנו זקוקים לערכי ריכוז היונים, אולם התרגיל סיפק את מולאריות המלח בתמיסה. כדי לקבוע את הריכוז של כל יון, פשוט הכפל את מולאריות המלח במקדם הסטואיכומטרי של המשתתף בתגובה:
לקטיון סידן:
[פה+2] = 1. 2,0. 10–3
[פה+2] = 2,0. 10–3 פְּרוּצָה
עבור אניון חנקתי:
[ב3-1] = 2. 2,0. 10–3
[ב3-1] = 4,0. 10–3 פְּרוּצָה
שלב 4: השתמש בערכי הריכוז שנמצאו בשלב 3 בביטוי Kps (נקבע בשלב 2).
Kps = [Ca+2]1.[ב3-1]2
Kps = [2.10-3]1.[4.10-3]2
Kps = 2.10-3.16.10-6
Kps = 32.10-9
אוֹ
Kps = 3.2.10-9 (מו / ליטר)
על ידי. דיוגו לופס דיאס
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kps.htm
