ניתוח או נפח נפחי זה נוהל מעבדה בו אנו משתמשים בנפח מסוים של a פִּתָרוֹן ב ריכוז ידוע כקובע את הריכוז של פתרון אחר. נפח הפתרון של הריכוז הידוע ייקבע כאשר הוא מגיב לחלוטין עם תמיסת הריכוז הלא ידוע, כלומר על הפתרונות המעורבים להגיב זה עם זה.
המכשירים הנפוצים ביותר למדידת נפח נתון הם:
- פִּיפֵּטָה

דוגמה לפיפטה המשמשת למדידת נפח
- בורט

הבורטה היא ציוד מדידה נפחי חשוב
מדידת הנפח מתבצעת על ידי הערכת גובה המניסקוס כביכול, שהוא לא יותר מאשר שטח הפנים של הנוזל, המציג היבט מלבני או כיפה (צורת טיפה), תלוי בעובי המיכל. ככל שהמיכל רחב יותר, כך המיניסקוס מלבני יותר; ככל שהמיכל דק יותר, כך הוא יהיה קמור יותר. כדי להעריך את המניסקוס, העין חייבת להיות בדיוק בגובהה ועלינו להשתמש באזור התחתון כנקודת התייחסות, אם המניסקוס מלבני, או בקצה, אם הוא מנופח. ראה ייצוג של הערכה:
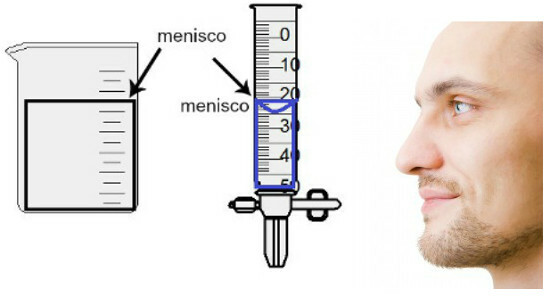
כדי להעריך מניסקוס, חשוב שעיניך יסתכלו אליו.
בניתוח נפחי, הציוד הנפוץ ביותר הוא הבורטה. הסיבה לכך היא שכיוון שהשיטה כוללת תגובות כימיות וניתן לעבד אותן במהירות, הבורטה מאפשרת זאת הנוזל משתחרר בקצהו בטיפות, מה שמאפשר לנו לעצור את הנוזל לצאת יותר מְבוּקָר.
אחד ההליכים הנפוצים ביותר בתחום הנפח הוא טיטרציה. זהו ניתוח נפחי הכרוך בהתרחשות תגובה בין חומצה לבסיס או להיפך. הציוד הנדרש למימושו מיוצג בתמונה למטה:
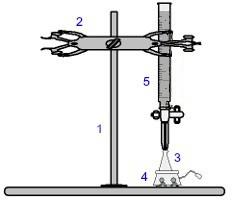
ייצוג הציוד המשמש בטיטרציה
המספרים בכחול פירושם:
1) תמיכה אוניברסלית;
2) טופר (נהג להחזיק את הבורטה);
3) ארלנמאייר (מקבל את הפתרון של ריכוז לא ידוע);
4) מערבל מגנטי (משמש לערבב את התמיסה הקיימת בבקבוק הארלנמאייר);
5) Burette (מקבל את הפתרון של ריכוז ידוע).
נפח של תמיסה בריכוז לא ידוע עם מחוון הפנולפטלין מתווסף לבקבוק הארלנמאייר (מיד הפתרון יהפוך לוורוד). ב burette, נפח מסוים של הפתרון של ריכוז ידוע ממוקם. לאחר מכן, תמיסת החומצה מהבורט מטפטפת ישירות לתמיסה הבסיסית בבקבוק הארלנמאייר. טפטוף זה נמשך עד שתמיסת הבסיס הופכת חסרת צבע, ובנקודה זו אנו מכנים נקודת המפנה, מה שמעיד על כך שכל הבסיס הקיים בתמיסה הגיב לחלוטין עם החומצה.
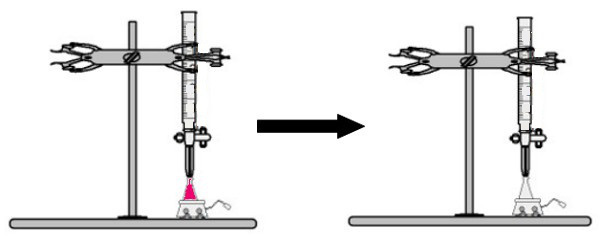
בנקודת המפנה הפתרון כבר אינו ורוד והופך לחסר צבע
תַצְפִּית: אם הפתרון של ריכוז לא ידוע הוא חומצי, כאשר הוא מקבל את מחוון הפנולפטלין, הוא יהיה חסר צבע. לפיכך, נקודת המפנה בטיטרציה תהיה כאשר התמיסה החומצית הופכת לורודה בעת קבלת התמיסה הבסיסית מהבורטה.
לבסוף, כדי לקבוע את ריכוז הפתרון הבסיסי, השתמש רק במשוואה הבאה:
Ma.Va = Mb.Vb
Ma = טוחנות חומצית;
Va = נפח חומצה;
Mb = מולריות בסיסית;
Vb = נפח בסיס.
כעת עקוב אחר דוגמה כיצד מתבצע חישוב של פתרון בעל מולאריות לא ידועה.
1) 30 מ"ל של פתרון בסיס לא ידוע נוספו לבקבוק ארלנמאייר על מנת לבצע טיטרציה לקביעת ריכוזו (מולריות). לתוך הבורט הוסיפו 50 מ"ל של תמיסת חומצה בריכוז 0.2 mol / L. לאחר הטלת תמיסת החומצה ועד לטיטרציה של התמיסה הבסיסית, נצפה כי נעשה שימוש ב -20 מ"ל מתמיסת החומצה בטיטרציה. קבע את הטוחנות של תמיסת הבסיס המשמשת.
נתוני התרגיל:
Vb = 30 מ"ל
Mb =?
Ma = 0.2 mol / L
Va = 20 מ"ל
מכיוון שהקוטביות של החומצה ונפח שלה הן, בהתאמה, 0.2 מול / ליטר ו- 20 מ"ל, ונפח הבסיס המשמש הוא 30 מ"ל, פשוט השתמש בנוסחת הטיטרציה:
Ma.Va = Mb.Vb
0.2.20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0.133 mol / L
על ידי. דיוגו לופס דיאס
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm
