החוק השלישי של התרמודינמיקה עוסק בהתנהגות החומר באנטרופיה המתקרבת לאפס.
על פי חוק זה, בכל פעם שמערכת נמצאת בשיווי משקל תרמודינמי, האנטרופיה שלה מתקרבת לאפס.
החוק השני של התרמודינמיקה מתייחס לאנטרופיה. בהמשך, החוק השלישי מופיע כ- נסה לקבוע נקודת ייחוס מוחלטת הקובעת את האנטרופיה.
וולטר נרנסט (1864-1941) היה הפיזיקאי שעסק בעקרונות שהיוו את הבסיס לחוק השלישי של התרמודינמיקה.
על פי נרנסט, לאנטרופיה יש ערך מינימלי אם הטמפרטורה של חומר טהור הייתה שווה לאפס מוחלט או מתקרב אליו.
לשם כך הציע נרנסט את הנוסחה שלהלן, המראה כי וריאציה של אנטרופיה (ΔS) וטמפרטורה (T) נוטות לערכים מינימליים, כלומר 0:
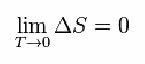
אבל מהי אנטרופיה?
אנטרופיה זו הדרך בה מולקולות מתארגנות במערכת. ארגון זה מתורגם לאי סדר, לא במובן של בלבול, אלא במובן של תנועה ותסיסה של מולקולות.
ככל שמולקולות יכולות לנוע יותר, כך הן יותר מסודרות, כך יש יותר אנטרופיה.
בתחילה הציע נרנסט שהאנטרופיה שהציע תתאפשר רק על גבישי גביש מושלמים.
לבסוף, הוא הגיע למסקנה שהטמפרטורה השווה לאפס מוחלט לא הייתה קיימת, מה שהופך את החוק השלישי לחוק שנוי במחלוקת.
לכן, עבור פיזיקאים רבים זה לא חוק אלא כלל.
לאחר כל כך הרבה שנים (מאז 1912), מדענים מנסים להשיג את הטמפרטורה הזו או את הטמפרטורות שמתקרבות יותר ויותר לאפס המוחלט. לפיכך, הם גילו שזה אפשרי רק בגזים, להשליך כל חומר במצב מוצק או נוזלי.
קרא גם:
- חוק אפס של תרמודינמיקה
- החוק הראשון של התרמודינמיקה
- החוק השני של התרמודינמיקה
- תרגילים על תרמודינמיקה