הטקסט טיטרציה הראה כיצד מתבצעת טכניקת ניתוח נפחית זו, שמטרתה העיקרית היא לזהות את ריכוז הפתרון באמצעות תגובתו עם פתרון אחר של ריכוז ידוע.
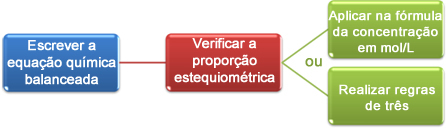
כעת, נראה כיצד להשתמש בנתונים המתקבלים בטיטרציה כדי להגיע לריכוז הרצוי, שיכול להיות חומצה או בסיס בתמיסה. לשם כך, ישנם בעצם שלושה שלבים:
בואו נסתכל על דוגמה:
נניח שלכימאי היה תמיסה של חומצה אצטית (חומץ (CH3COOH(פה))) ורצה לגלות את ריכוזו במול / ליטר. לאחר מכן הניח 20.0 מ"ל חומץ (טיטרציה) בבקבוק ארלנמאייר והוסיף את מחוון הפנולפטלין. ואז הוא מילא בורטה של 100 מ"ל עם נתרן הידרוקסיד (NaOH) בריכוז ידוע (טיטרנט) השווה ל -1.0 מול / ליטר. לבסוף, הכימאי ביצע את הטיטרציה והבחין כי שינוי הצבע (נקודת המפנה - כשהוא עצר את הטיטרציה) התרחש כאשר נצרך 24 מ"ל NaOH.

על סמך ניסוי זה הוא השיג את הנתונים הבאים:
MCH3COOH= ?
וCH3COOH = 20 מ"ל = 0.02 ליטר
MNaOH = 24 מ"ל = 0.024 ליטר
וNaOH = 1.0 mol / L
איפה M = ריכוז ב mol / L ו- V = נפח ב L.
כדי לברר את ריכוז החומצה האצטית, עלינו לדעת תחילה לכתוב את המשוואה הכימית המייצגת את תגובת הנטרול המאוזנת כראוי שהתרחשה. במקרה זה, התגובה היא כדלקמן:
1 CH3COOH(פה) + 1 NaOH(פה) → 1 NaC2ה3או2 (aq) + שעה2או(ℓ)
חלק זה חשוב לראות את היחס הסטואיכיומטרי בו מגיבים המגיבים. שים לב שהיחס הוא 1: 1, כלומר לכל שומה של חומצה אצטית יש צורך בשומה אחת של נתרן הידרוקסיד.
כעת נוכל להמשיך בחישובים בשתי דרכים:
(1) דרך הנוסחה: M1. ו1 = M2. ו2
מכיוון שהיחס הסטואיכיומטרי הוא 1: 1, עלינו: לאCH3COOH = nNaOH .
להיות M = n / V → n = M. ו. לפיכך, אנו מגיעים לרשימה שלעיל, שבמקרה זה ניתן לכתוב כך: MCH3COOH. CH3COOH = MNaOH. וNaOH
לכן, פשוט החליפו את הערכים של הנוסחה הזו:
MCH3COOH. ו CH3COOH = MNaOH. וNaOH
MCH3COOH. 0.02 ליטר = 1.0 מול / ליטר. 0.024 ל '
MCH3COOH = 0.024 mol
0.02 ליטר
MCH3COOH = 1.2 mol / L
לכן, הריכוז הראשוני של תמיסת החומצה האצטית, הכותרת שלנו, היה 1.2 mol / L.
הערה חשובה: אם היחס הסטואיכומטרי לא היה 1: 1, זה היה מספיק כדי להכפיל את הריכוז במול / ליטר (M) של החומרים במקדמים שלהם. לדוגמה, אם היחס היה 1: 2, יהיה לנו את הדברים הבאים:
M1. ו1 = 2. M2. ו2
אך הנה דרך נוספת לבצע חישובים אלה:
(2) באמצעות כללים של שלושה:
1 CH3COOH(פה) + 1 NaOH(פה) → 1 CH3COONa(פה) + שעה2או(ℓ)
1 mol 1 mol 1 mol 1 mol
1. 60 גרם 1. 40 גרם 1. 82 גרם 1. 18 גרם
מסות אלה הן המסות המולקולריות המחושבות עבור כל חומר.
* בידיעה שהנפח המושקע של תמיסת NaOH 1.0 mol / L(פה) היה 24 מ"ל, ראשית נוכל לגלות את כמות החומר (מול) של NaOH שהגיבה:
1 מול של NaOH → 1.0 ליטר
1 mol של NaOH 1000 מ"ל
x 24 מ"ל
x = 0.024 mol של NaOH
מכיוון שהיחס הוא 1: 1, כמות החומר (mol) של חומצה אצטית צריכה להיות זהה ל- NaOH: 0.024 mol.
תַצְפִּית: אם היחס הסטואיכיומטרי היה שונה, היינו לוקחים את זה בחשבון בחלק זה. לדוגמא, אם זה היה 1: 3 וכמות החומר של מין כימי אחד המגיב הייתה שווה ל -0.024 מול, אז זה של החומר האחר היה משולש: 0.072.
* כעת אנו מחשבים:
20 מ"ל חומץ 0.024 מול של חומצה אצטית
1000 מ"ל חומץ ו
y = 1.2 מול
כלומר, יש 1.2 mol / L, שזה אותו ערך שקיבלנו בשיטה הקודמת.
מאת ג'ניפר פוגאצה
בוגר כימיה
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/quimica/calculos-envolvidos-na-titulacao.htm
