קשר קוולנטי הוא סוג של אינטראקציה בין אטומים בעלי גבוה שליליות אלקטרוניתכלומר נטייה גבוהה לקבלת אלקטרונים. היסודות הכימיים המעורבים בדרך כלל בקשר מסוג זה הם:
מימן (H)
בריליום (Be)
בורון (ב)
פחמן (C)
חנקן (N)
זרחן (P)
חמצן (O)
גופרית (S)
פלואור (F)
כלור (קל)
ברום (בר)
יוד (אני)
א) אופי היסודות המעורבים
היסודות הכימיים שיש להם אלקטרוגטיביות גבוהה וכתוצאה מכך מבצעים קשרים קוולנטיים הם:
מֵימָן
אמטלים
ב) הופעת הקשר הקוולנטי
בהתאם לאופי היסודות הכימיים המעורבים בקשר הקוולנטי, זה יכול להתרחש באופן הבא:
בין שני אטומי מימן;
בין אטום שאינו מתכת למימן;
בין אטומים מאותו יסוד כימי (לא מתכתי);
בין אטומים של יסודות כימיים שונים (שניהם שאינם מתכות).
ג) מספר האלקטרונים שכל אטום חייב לקבל
מספר האלקטרונים שכל אטום מימן או מתכת מקבל בקשר קשור ל- חוק האוקטט.
על פי כלל האוקטט, אטום יציב כאשר הוא רוכש שמונה או שניים אלקטרונים (רק במקרה של מימן) במעטפת הערכיות. אם אטום כולל חמישה אלקטרונים בקליפת הערכיות שלו, למשל, עליו לקבל שלושה אלקטרונים כדי להשיג יציבות.
הערה: בריליום ובורון הם חריגים לכלל האוקטט, כאשר הם הופכים יציבים, בהתאמה, עם 4 ו -6 אלקטרונים במעטפת הערכיות.
ניתן לקבוע בקלות את מספר האלקטרונים במעטפת הערכיות על ידי ניתוח משפחת היסודות הכימיים. בטבלה שלהלן יש לנו את מספר האלקטרונים בקליפת הערכיות המתייחסת למשפחה אליה שייך היסוד ומספר האלקטרונים שהוא צריך לקבל כדי להשיג יציבות:

ד) עקרון קשר קוולנטי
כמו בקשר קוולנטי, לכל האטומים המעורבים יש נטייה לקבל אלקטרונים, באופן מחייב, יהיה ביניהם שיתוף של האלקטרונים הנמצאים בקליפת הערכיות (הרמה הרחוקה ביותר מהגרעין).
שיתוף מתרחש כאשר אלקטרון מקליפת הערכיות של אטום הופך לחלק מאותו ענן אלקטרוני שמקיף אלקטרון אחר מקליפת הערכיות של אטום אחר.
לכל אטום מימן, למשל, יש אלקטרון בקליפת הערכיות. כששני אלקטרונים הופכים לחלק מאותו ענן, לכל מימן מתחילים להיות שני אלקטרונים ערכיים, כלומר הוא מתייצב.
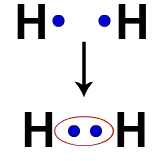
אלקטרונים של שני אטומי מימן התופסים את אותו ענן אלקטרונים
ה) נוסחאות המשמשות בקשירה קוולנטית
1ª) נוסחה מולקולרית
זהו האינדיקציה למספר האטומים של כל יסוד היוצרים את המולקולה שמקורם בקשרים קוולנטיים.
דוגמה: ח2או
במולקולת המים יש לנו 2 אטומי מימן ואטום חמצן אחד.
2ª) נוסחה מבנית
הנוסחה המבנית היא הדגמת הארגון של המולקולה, כלומר היא מדגימה את הקשרים בין האטומים. לשם כך משתמשים במקפים שמייצגים את הקשר של כל אטום:
פשוט (?): מציין שהאטום חלק רק אלקטרון אחד מקליפת הערכיות שלו עם אטום אחר ולהיפך;
כפול (?): מציין שהאטום חלק שני אלקטרונים מקליפת הערכיות שלו עם האטום השני ולהיפך;
משולש (≡): מציין שהאטום חלק שלושה אלקטרונים מקליפת הערכיות שלו עם אטום אחר ולהיפך.
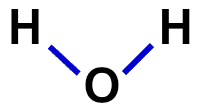
נוסחה מבנית של מים
3ª) הנוסחה האלקטרונית של לואיס
הנוסחה האלקטרונית של לואיס מייצגת גם את הארגון של המולקולה (הנוסחה האלקטרונית), אך היא שואפת להדגים את שיתוף האלקטרונים באטומים.
כדי לבנות אותו, מספיק לכבד את הארגון המוצע בנוסחה מבנית ולהחליף כל זכר לקשרים (יחיד, כפול או משולש) ב"שני כדורים ", המייצגים את האלקטרונים.
בנוסחה המבנית של מים, למשל, יש לנו שני קשרים פשוטים בין מימנים לחמצן. כך, ביניהם, יהיו לנו שני כדורים בלבד, שתוחמו על ידי אליפסה (המייצגת את הענן האלקטרוני).
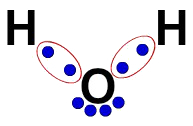
הנוסחה האלקטרונית של לואיס למים
על ידי. דיוגו לופס דיאס
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-covalente.htm
