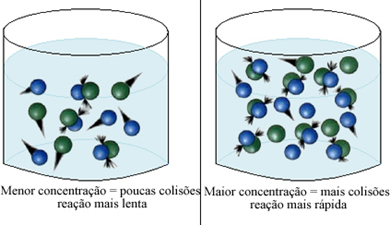
אנו יכולים לציין זאת בכל פעם שאנו מגדילים את הריכוז של אחד המגיבים המשתתפים בתגובה כימית או את כולם, יש עלייה בקצב ההתפתחות שלה, כלומר במהירות התגובה.
ההפך הוא הנכון. לדוגמא, כרגע מומלץ להשתמש בג'ל אלכוהול במקום באלכוהול רגיל, מכיוון שיש פחות סיכון לבעירה ובכך להימנע מתאונות. אלכוהול נוזלי רגיל הוא למעשה תערובת של אלכוהול ומים, עם אלכוהול ג'ל המכיל פחות אלכוהול. לכן, כאשר ריכוז אחד ממגיבי הבעירה מצטמצם, במקרה של אלכוהול, התגובה מתנהלת לאט יותר. מצד שני, ככל שהאלכוהול טהור יותר, תגובת הבעירה מהירה יותר.

כאמור בטקסט תנאים להופעת תגובות כימיות, אחד התנאים להתרחשות התגובה הוא התנגשות יעילה בין החלקיקים. לכן, העלייה בריכוז הריאגנטים מאפשרת לכמות גדולה יותר של חלקיקים או מולקולות באותו חלל. זה מגדיל את כמות ההתנגשויות ביניהם וגם מגדיל את הסבירות שיתרחשו התנגשויות יעילות שיגרמו להתרחשות התגובה. התוצאה היא שהתגובה מתרחשת מהר יותר.
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
כדי לראות זאת, חשוב על הדוגמה הבאה: כאשר יש לנו גחלת בוערת ואנחנו רוצים שהבעירה הזו תעבד מהר יותר, האם אנו נושפים או מאווררים את הגחלת? מדוע זה עובד?
ובכן, אחד המגיבים בתגובת הבעירה הזו הוא חמצן באוויר. כאשר אנו רועדים, זרם האוויר מסיר את האפר הנוצר במהלך הבעירה וזה מקל על מגע החמצן עם הגחלת. באופן זה אנו מגדילים את המגע בין המגיבים ומאיצים את תגובת הבעירה.
בקצרה, יש לנו:

כשעובדים עם גזים, אחת הדרכים להגביר את ריכוז המגיבים היא להוריד את הלחץ. כאשר אנו עושים זאת, אנו מקטינים את עוצמת הקול וכתוצאה מכך יש עלייה בריכוזי המגיב.

מאת ג'ניפר פוגאצה
בוגר כימיה
האם תרצה להתייחס לטקסט זה בבית ספר או בעבודה אקדמית? תראה:
FOGAÇA, ג'ניפר רושה ורגס. "ריכוז התגובות ומהירות התגובות"; בית ספר ברזיל. אפשר להשיג ב: https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm. גישה אליו ב -27 ביוני 2021.


