לורנצו רומנו אמדו קרלו אבוגדרו (1776-1856) היה כימאי איטלקי שביסס לראשונה את הרעיון כי לדוגמא של יסוד, עם מסה בגרם השווה מספרית למסה האטומית שלו, תמיד יש אותו מספר אטומים (N).
אבוגדרו עצמו לא הצליח לקבוע את ערכו של נ. עם זאת, לאורך המאה העשרים, התקדמות הטכנולוגיה והידע המדעי אפשרה למדענים אחרים לפתח טכניקות לקביעתה. כשסוף סוף התגלה ערך זה נקרא קבוע של אבוגדרו, לכבוד המדען הזה, שכן הוא זה שהניח את היסודות ליצירתו.

לורנצו רומנו אמדו קרלו אבוגדרו (1776-1856)
בשומה אחת מכל ישות (אטומים, מולקולות, אלקטרונים, נוסחאות או יונים) כלול בדיוק את הערך של הקבוע של אבוגדרו.
הטבלה שלהלן מציגה כמה ערכים לקבוע של אבוגדרו שהושג במהלך המאה ה -20:
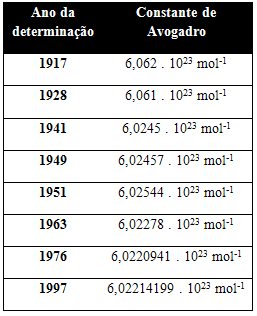
להלן כמה מהטכניקות המשמשות לניסיון לקבוע את ערך הקבוע של אבוגדרו:
המדען הראשון שערך חישוב משוער עבור קבועו של אבוגדרו היה יוהאן ג'וזף לושמידט. בשנת 1867 התבסס על התיאוריה הקינטית של גזים וקבע כמה מולקולות קיימות בס"מ אחד3 של גז.
עוד אחד מהמדענים הללו היה הצרפתי ז'אן בפטיסט פרין (1870-1942) שספר את מספר החלקיקים הקולואידים ליחידת נפח בתלייה ומדד את המוניהם. הערך שמצא היה בין 6.5 ל 7.2. 10
23 ישויות למול. מדען זה פרסם, בשנת 1913, את הספר לס אטומס (מהדורה ראשונה פריז: אלקן), ומהדורתו ה -9, שפורסמה בשנת 1924, הכילה 16 דרכים להשיג באופן קבוע את הקבוע של אבוגדרו.אל תפסיק עכשיו... יש עוד אחרי הפרסום;)

ז'אן בפטיסט פרין (1870-1942)
שנים מאוחר יותר, המדען ג'יימס דיואר (1842-1923) השתמש בשיטה שפותחה שנים קודם לכן על ידי הרדיוכימאי ברטרם בולטווד (1870-1927) והפיזיקאי ארנסט. רתרפורד (1871-1937), שכלל בעצם ספירת חלקיקי האלפא הנפלטים ממקור רדיואקטיבי וקביעת נפח גז הליום שהושג. הערך שמצא דיוור היה 6.04. 1023 mol-1.
עוד במאה ה -20, רוברט מיליקן (1868-1953) ביצע ניסוי לקביעת מטען האלקטרון (1.6. 10-19 Ç). מכיוון שכבר היה ידוע על המטען של 1 שומה אלקטרונים (96500 צלזיוס), ניתן היה לקשר בין שני הערכים הללו ולמצוא את הערך הבא לקבוע של אבוגדרו: 6.03. 1023 mol-1.
נכון לעכשיו, הערך המומלץ לקבוע של אבוגדרו הוא 6.02214 x 1023 mol-1 והוא נקבע באמצעות עקיפה של רנטגן, בה מתקבל נפח של כמה אטומים של סריג גבישי, כל עוד ידוע על הצפיפות והמסה של 1 מול אטומים במדגם.
למטרות דידקטיות בתיכון, שם החישובים אינם צריכים להיות מדויקים כמו אלה שבוצעו במעבדות כימיות, הקבוע של אבוגדרו נחשב כ 6,02. 1023 mol-1.
ישנן גם שיטות פשוטות יותר בהן ניתן להשתמש כדי לעזור לתלמידים לקבוע את הקבוע של אבוגדרו בפועל. אחת מהן היא באמצעות אלקטרוליזה במדיום מימי.
מאת ג'ניפר פוגאצה
בוגר כימיה
האם תרצה להתייחס לטקסט זה בבית ספר או בעבודה אקדמית? תראה:
FOGAÇA, ג'ניפר רושה ורגס. "קביעת הקבוע של אבוגדרו"; בית ספר ברזיל. אפשר להשיג ב: https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm. גישה אליו ב -28 ביוני 2021.



