כל תא הוא מכשיר שבו מתרחשת תגובת הפחתת חמצון ספונטנית המייצרת זרם חשמלי, אשר בתורו משמש כדי לגרום לציוד כלשהו לעבוד.
מכשירים אלה קיבלו את שמם כי הסוללה הראשונה שנוצרה הומצאה על ידי אלסנדרו עוד בשנת 1800 הוא נוצר על ידי דיסקי אבץ ונחושת המופרדים על ידי כותנה ספוגה מי מלח. סט זה הוצב זה לזה, גִבּוּב את הדיסקים ויוצרים טור גדול. איך היה א סוֹלְלָה של דיסקים, החלו להיקרא בשם זה.

הסוללות מורכבות תמיד משתי אלקטרודות ואלקטרוליט. האלקטרודה החיובית נקראת a קָטוֹדָה וכאן התגובה של צִמצוּם. האלקטרודה השלילית היא אָנוֹדָה וכאן התגובה של חִמצוּן. אלקטרוליט נקרא גם גשר מלח והוא הפתרון המוליך יונים.
כדי שתבין כיצד זה מייצר זרם חשמלי, עיין במקרה של אחת הסוללות הראשונות, ערימתו של דניאל, שבו היה מיכל עם תמיסה של סולפט נחושת (CuSO4 (aq)) וטבול בתמיסה זו היה לוח נחושת. במיכל נפרד אחר היה פתרון של אבץ סולפט (ZnSO4 (aq)) וצלחת אבץ טבולה. שני הפתרונות חוברו באמצעות גשר מלח, שהיה צינור זכוכית עם תמיסת אשלגן גופרתי (K2רק4 (aq)) עם צמר זכוכית בקצוות. לבסוף, שתי הלוחות היו מחוברים ביניהם על ידי מעגל חיצוני, עם מנורה, שתאורתה תעיד על מעבר זרם חשמלי:
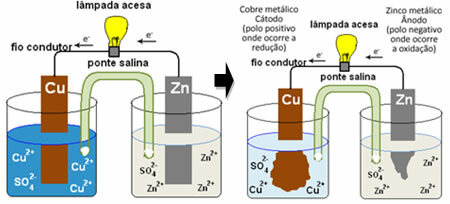
מה שקורה הוא שלאבץ יש נטייה גדולה יותר להתחמצן, כלומר לאבד אלקטרונים, ולכן האבץ המתכתי של הלהב פועל כאלקטרודה השלילית, האנודה, שבה מתרחשת חמצון: Zn(ים) ↔ זן2+(פה) + 2 ו-. האלקטרונים שאבדו על ידי האבץ מועברים באמצעות המעגל החיצוני אל הנחושת, ויוצרים את הזרם החשמלי שמדליק את המנורה. יוני הנחושת בתמיסה מקבלים אלקטרונים (מצמצמים) והופכים לנחושת מתכתית המופקדת על יריעת הנחושת. משמעות הדבר היא שזו האלקטרודה החיובית, הקתודה, בה מתרחשת ההפחתה: תַחַת2+(פה) + 2 ו- התחת(ים).
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
לסוללות של ימינו יש אותו עיקרון הפעלה, שבו מתכת אחת תורמת אלקטרונים לאחרת, באמצעות פתרון מוליך, ומייצר זרם חשמלי. ההבדל הוא שהסוללות בהן משתמשים כיום יבשות, מכיוון שאינן משתמשות בתמיסה נוזלית כאלקטרוליט, כפי שקורה בסוללה של דניאל.
כיום יש מגוון רחב מאוד של סוללות הנמכרות באופן מסחרי. ביניהם הנפוצים ביותר הם תאי חומצה (מ Leclanché) והסוללות אלקליין.
לשניהם אבץ כאלקטרודה השלילית; מצד שני, כקוטב חיובי, יש מוט גרפיט המותקן באמצע הערימה המוקף דו חמצני מנגן (MnO2), אבקת פחם (C) ומשחה רטובה. ההבדל הוא שבערמת החומצה משתמשים באמוניום כלוריד (NH) במשחה הרטובה.4Cl) ואבץ כלורי (ZnCl2) - מלחים בעלי אופי חומצי - בנוסף למים (H2O). בסוללה האלקליין משתמשים באשלגן הידרוקסיד (KOH), שהוא בסיס.

סוללות Leclanché מתאימות ביותר לציוד הדורש פריקה קלה ורציפה, כגון שלט רחוק, שעון קיר, רדיו נייד וצעצועים. לעומת זאת, לסוללות אלקליין 50 עד 100% יותר אנרגיה מסוללה נפוצה באותו גודל, ומומלצת לציוד ש דורשים הורדות מהירות ואינטנסיביות יותר כמו מכשירי רדיו, נגני CD / DVD, נגני MP3 ניידים, פנסים, מצלמות סטילס דיגיטליות וכו '

למידע נוסף על אילו אלקטרוליטים ואלקטרודות משמשים גם בסוגים אלה ואחרים של סוללות. באשר לסוגי הציוד שהם הכי מומלצים, קרא עוד את המאמרים בנושא לִגעוֹת.
מאת ג'ניפר פוגאצה
בוגר כימיה

