ה משוואת clapeyron הוא ביטוי מתמטי המתייחס לכמויות כגון לַחַץ (P), נפח (V), טמפרטורה (T) ומספר החלקיקים (n) המרכיבים a גז מושלם או אידיאלי. משוואה זו נקראת על שם הפיזיקאי הצרפתי פולאמילקלפיירון וניתן להבין זאת כהכללה של החוקים האמפיריים של גזיםמושלםבגיי-לוסאק, צ'רלס ובייל. זה היה יסוד לחקר הגזים האידיאליים ואיפשר את התפתחותם של מכונות תרמיות, מה שהופך אותם ליעילים יותר ויותר בעשורים האחרונים.
ראה גם: תגליות פיזיקה שקרתו בתאונה
משוואת קלפיירון: חוק הגז האידיאלי
המשוואה של קלפיירון היא נגזר משלושה חוקים אמפירייםכלומר חוקים שנקבעו מניסויים. חוקים כאלה מסבירים את התנהגות הגזים ב טרנספורמציות גזאיזובולומטרי (חוק גיי-לוסק), איזוברי (חוק צ'ארלס) ו איזותרמות (חוק בויל). על פי חוקים אלה:
בתמורות איזובולומטרי, היחס בין לחץ לטמפרטורה תרמודינמית של גז אידיאלי נשאר קבוע;
בתמורות איזוברי, היחס בין הנפח לטמפרטורה התרמודינמית של גז אידיאלי הוא קבוע;
- בתמורות איזותרמותתוצר הלחץ והנפח של גז אידיאלי נשאר קבוע.
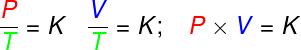
פ - לחץ (אבא - פסקל)
ו - נפח גז (m³)
ט - טמפרטורת גז תרמודינמית (K - קלווין)
משלושת החוקים לעיל, משוואת קלפיירון קובעת מה הערך של זה
קָבוּעַ (ק) שהושגו בכל אחת מהטרנספורמציות הנ"ל. על פי המשוואה של קלפיירון, קבוע זה שווה למספר השומות המוכפלות ב- a קבוע R, המכונה הקבוע האוניברסלי של גזים אידיאליים, ושווה ל- בולצמן קבוע כפול המספר של אבוגדרו.
נוּסחָה
בדוק את הנוסחה הידועה בשם משוואהבקלפיירון:
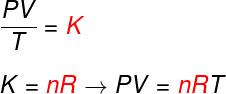
לא - מספר שומות (mol)
ר - קבוע אוניברסלי של גזים אידיאליים (R = 0.082 atm.l / mol. K או 8.314 J.mol / K)
ניתוח משוואת Clapeyron, ניתן לראות כי לַחַץ המופעל על ידי גזים אידיאליים הוא ביחס ישר לטמפרטורה וגם ל מספר שומות. יתר על כן, הלחץ הוא ביחס הפוך לנפח תפוס על ידי גז.
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
או דגם גז אידיאלי מתאפשרת על ידי משוואת Clapeyron נעשה שימוש נרחב עבור פיתוח מכונות המופעלות באמצעות נוזלים, כגון מכונות המונעות בקיטור ומנועי בעירה פנימית.
ניתן להשיג מספר תוצאות חשובות ממשוואת קלפיירון. אחד מהם, למשל, חוזה כי שומה אחת מכל גז אידיאלי תופסת נפח של 22.4 ליטר כאשר הוא נתון ללחץ של כספומט אחד (1,01.105 Pa) ובטמפרטורה של 273K (0 מעלות צלזיוס).
ראה גם: המושגים החשובים ביותר בתרמולוגיה
תרגילים נפתרו על משוואת קלפיירון
שאלה 1 - (UECE) לגז שיכול להיות שקשורים בטמפרטורה, בנפח ולחץ על ידי PV = nRT יש את המאפיינים הבאים:
א) מרחק ממוצע גדול מאוד בין מולקולות בכדי להתעלם מאינטראקציות בין מולקולריות, למעט בעת התנגשות; מולקולות עוברות התנגשויות אלסטיות.
ב) מרחק ממוצע קטן מאוד בין מולקולות; מולקולות עוברות התנגשויות לא אלסטיות.
ג) מרחק ממוצע גדול מאוד בין מולקולות בכדי להתעלם מאינטראקציות בין מולקולריות, למעט בעת התנגשות; מולקולות עוברות התנגשויות לא אלסטיות.
ד) מרחק ממוצע גדול מאוד בין מולקולות ועם אינטראקציות בין-מולקולריות חזקות; מולקולות עוברות התנגשויות אלסטיות.
פתרון הבעיה:
במודל הגז האידיאלי, מספר רב של חלקיקים חסרי ממד נעים במהירות גבוהה לכיוונים אקראיים. האינטראקציה היחידה שסבלו מחלקיקים אלה היא התנגשויות אלסטיות לחלוטין, ולכן האלטרנטיבה הנכונה היא מכתב.
שאלה 2 - (UFRGS) שקול את ההצהרות הבאות לגבי גזים אידיאליים.
אני. ל- R הקבוע הקיים במשוואת המצב לגזים pV = nRT אותו ערך לכל הגזים האידיאליים.
II. נפחים שווים של גזים אידיאליים שונים, באותה טמפרטורה ולחץ, מכילים את אותו מספר מולקולות.
III. האנרגיה הקינטית הממוצעת של המולקולות של גז אידיאלי עומדת ביחס ישר לטמפרטורה המוחלטת של הגז.
אילו נכונים?
א) רק אני
ב) רק II
ג) רק III
ד) רק אני ו- II
ה) I, II ו- III
תבנית:
בואו נסתכל על החלופות:
אני. נכון, מכאן שהוא נקרא הקבוע האוניברסלי של גזים אידיאליים.
II. נכון. על פי המשוואה של Clapeyron, אם לשני גזים אידיאליים יש אותו לחץ, טמפרטורה ונפח, מספר החלקיקים בגזים אלה שווה.
III. נכון. על פי משפט חלוקת האנרגיה, האנרגיה הקינטית של חלקיקים בגז אידיאלי פרופורציונאלית לטמפרטורה שלו.
לכן, האלטרנטיבה הנכונה היא אות ה.
שאלה 3 - (UFJF) גברים כמו Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls, בין היתר, פיתחו מחקרים חשובים הקשורים לתכונות של גזים. התנהגותם של גזים אמיתיים מתקרבת לגזים אידיאליים בתנאי לחץ נמוך, כמו גם לגזים הכלולים בנפח גדול וגזים המוחזקים בטמפרטורות גבוהות. קחו בחשבון שבניסוי מעבדה מיכל בנפח V סגור לחלוטין ומכיל 1 מול של גז אידיאלי בלחץ של 4.0 כספומט נתון להתרחבות בטמפרטורה קבועה השווה ל- 127 מעלות צלזיוס וכי התנהגותו של גז זה היא של גז אידיאלי, כפי שמוצג ב גרפי.
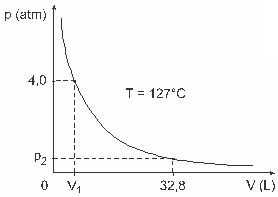
במקרה זה, כאשר הגז תופס נפח השווה ל -32.8 ליטר, הלחץ המופעל על ידו יהיה:
(נתון: הקבוע האוניברסלי של גזים מושלמים הוא R = 0.082 atm. L / mol. ק.)
א) כספומט 0.32
ב) 0.40 כספומט
ג) 1.0 כספומט
ד) כספומט 2.0
ה) 2.6 כספומט
פתרון הבעיה:
אות ג '.
כדי לפתור את התרגיל, עלינו להחיל את הנתונים על משוואת קלפיירון, אך לפני כן עלינו להפוך את הטמפרטורה, שהיא במעלות צלזיוס, לקלווין. לבדוק:

מאת רפאל הלרבוק
מורה לפיזיקה