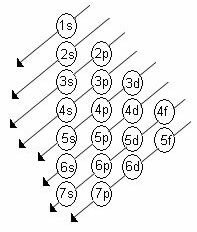
אם אנו מנתחים את ההתפלגות האלקטרונית של אטום נתון בתרשים האנרגיה (או בתרשים של פאולינג) ניתן 'לחזות' שתי שאלות הנוגעות למיקום יסוד האטום הזה בטבלה תְקוּפָתִי: התקופה והמשפחה.
הבה נבחן תחילה את התקופה:

לדוגמה, שקול את המקרה של ארבעה אלמנטים מתקופות שונות:
·להיות (Z = 4): א סדר גיאומטרי של ההפצה האלקטרונית של בריליום הוא: 1s2 / 2ס2.
ראו ששתי רמות התמלאו, כך שהבריליום הוא מה 2º קורס זמן.
·Na (Z = 11): הסדר הגיאומטרי של ההפצה האלקטרונית של נתרן הוא: 1s2 / 2s2 2p6 / 3ס1.
במקרה זה, 3 רמות התמלאו, כך שהנתרן הוא מה 3º קורס זמן.
·As (Z = 33): הסדר הגיאומטרי של ההתפלגות האלקטרונית של ארסן הוא: 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s24פ3.
4 רמות התמלאו, כך שהארסן הוא מה 4º קורס זמן.
·I (Z = 53): הסדר הגיאומטרי של חלוקת היוד האלקטרונית הוא: 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p6 4 ד10 / 5s25פ5.
5 רמות התמלאו, כך שהיוד הוא מה- 5º קורס זמן.
הבה נבחן כיצד אנו יכולים לגלות את משפחת האלמנטים:

ראה כיצד זה קורה בכל אחת מקבוצות האלמנטים שהוזכרו לעיל:
·אלמנטים מייצגים:
אלמנטים אלה הם אלה השייכים למשפחות: 1, 2, 13, 14, 15, 16, 17 ו -18. הם נקראים גם אלמנטים אופייניים או אופייניים ובטבלאות שעדיין לא עודכנו הם תואמים את האלמנטים שנמצאים בעמודות A (IA, IIA, IIIA, IVA, VA, VIA, VIIA, VIII A).
בכל פעם שהאלקטרון האנרגטי ביותר נמצא ברמת משנה s או p, זה יהיה אלמנט מייצג. יתר על כן, סכום האלקטרונים שמולאו ברמה החיצונית ביותר מראה לנו מה המשפחה שלהם בהתאמה.
ראה כיצד זה קורה:
·משפחה 1: לכולם יש אלקטרון אחד ברמת האנרגיה האחרונה.
דוגמאות:
1H: 1s1 → למרות היותו מתכת אלקלית, מימן מופיע בטבלה במשפחה 1 מכיוון שיש לו אלקטרון אחד בקליפתו האחרונה והיחידה.
3קראתי: 1 שניות2 / 2s1
11ב: 1 שניות2 / 2s2 2p6 / 3s1
19K: 1s2 / 2s2 2p6 / 3s2 3p6 / 4s1
37Rb: 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p6 / 5s1
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
55Cs: 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p6 4 ד10 / 5s2 5p6 / 6s1
87Fr: 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p6 4 ד10 4f14 / 5s2 5p6 5d10 / 6s2 6p6 / 7s1
לפיכך, אנו יכולים להסיק שהתצורה האלקטרונית של אלמנטים של קבוצה זו מסתיימת ב לָנוּ1 (n = 1 עד 7).
זה עוזר לנו לראות שיש אז הכללה לקבוצות או למשפחות אחרות:
·משפחה 2: לכולם 2 אלקטרונים ברמה האחרונה ותצורת האלקטרונים מסתיימת ב לָנוּ2.
·משפחה 13: לכולם 3 אלקטרונים ברמה האחרונה ותצורת האלקטרונים מסתיימת לָנוּ2 np1.
·משפחה 14: לכולם 4 אלקטרונים ברמה האחרונה ותצורת האלקטרונים מסתיימת לָנוּ2 np2.
·משפחה 15: לכולם 5 אלקטרונים ברמה האחרונה ותצורת האלקטרונים מסתיימת ב לָנוּ2 np3.
·משפחה 16: לכולם 6 אלקטרונים ברמה האחרונה ותצורת האלקטרונים מסתיימת לָנוּ2 np4.
·משפחה 17: לכולם 7 אלקטרונים ברמה האחרונה ותצורת האלקטרונים מסתיימת ב לָנוּ2 np5.
- אלמנטים מעבר חיצוניים:
אלמנטים המעבר הם אלה שנמצאים במשפחות בין 3 ל 12, ואלמנטים המעבר החיצוניים הם אלה שנחשפים (חיצוניים). בטבלאות הישנות, רכיבי המעבר תופסים את העמודות ב '.
יש להם את האלקטרון יותר אנרגטי על רמת משנה ד לא שלמה. התצורה האלקטרונית שלך מסתיימת ב לָנוּ2 (n-1) ד (1 עד 8).
ראה שתי דוגמאות, שההגדרות שלהן כעת בסדר אנרגיה:
28Ni: 1s2 2s2 2p6 3s2 3p6 4s23d8
39Y: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s24 ד1
- אלמנטים מעבר פנימיים:
אלה אלמנטים שתופסים את קבוצה 3 של הטבלה המחזורית, אך נותרים פנימיים וכדי לראות אותם, אנו מושכים קו החוזר על תקופות 6 ו -7 מתחת לטבלה. תקופה 6 נקראת סדרת לנתניד, ותקופה 7 היא סדרת אקטיניד.

לאלמנטים מעבר פנימיים יש את האלקטרון האנרגטי ביותר של האטום במצב הקרקע ב- רמת משנה לא מלאה f. התצורה האלקטרונית שלך מסתיימת ב לָנוּ2 (n - 2) ו (1 עד 13).
דוגמה עם תצורה אלקטרונית בסדר כוח:
57La: 1s2 / 2s2 2p6 / 3s2 3p6 4s2 3d10 4p6 5s2 4 ד10 5p66s2 4f1.
מאת ג'ניפר פוגאצה
בוגר כימיה
האם תרצה להתייחס לטקסט זה בבית ספר או בעבודה אקדמית? תראה:
FOGAÇA, ג'ניפר רושה ורגס. "טבלה מחזורית ותרשים אנרגיה של אלמנטים"; בית ספר ברזיל. אפשר להשיג ב: https://brasilescola.uol.com.br/quimica/tabela-periodica-diagrama-energia-dos-elementos.htm. גישה אליו ב -27 ביוני 2021.