Di solito le reazioni di elettrolisi acquosa e elettrolisi ignea sono effettuati con elettrodi di grafite e platino, che non partecipano alla reazione; conducono solo corrente elettrica. Tuttavia, ci sono alcuni casi specifici in cui è necessario utilizzare elettrodi attivi, cioè che subiscono riduzione e ossidazione.
I principali casi d'uso di questi elettrodi che partecipano al processo redox sono: a purificazione elettrolitica dei metalli, come zinco, cobalto, nichel e soprattutto rame; e anche il galvanica. Vediamo come si verifica ogni caso:
• Purificazione elettrolitica del rame: questa raffinazione elettrolitica del rame può produrre una purezza di circa il 99,9% e viene utilizzata principalmente per realizzare fili di rame che, se hanno la minima quantità di impurità, possono avere la loro capacità di condurre corrente molto elettrica electrical diminuito.
Osserva come avviene questo processo, vedendo lo schema di una vasca elettrolitica assemblato di seguito:

Una differenza di potenziale viene applicata alla soluzione acquosa di solfato di rame (CuSo
4(ac)) – che conduce elettricità – per cui l'anodo, che è un rame metallico impuro, perde elettroni, cioè subisce ossidazione, liberando i suoi cationi (Cu2+), che si depositano sulla lastra negativa. Questa potrebbe essere una lastra di platino inerte, o, meglio, una lastra di rame puro. Costituisce il catodo, che si riduce man mano che in esso si deposita il rame. Pertanto, le semireazioni che si verificano negli elettrodi sono:Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
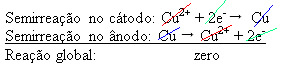
Il fatto che abbia dato un risultato zero indica che non c'è stata reazione chimica, ma solo il trasporto del rame. Sul fondo del contenitore ci sono le altre sostanze impure che erano nel rame come oro, argento, silice (sabbia) e altri minerali, che possono anche essere venduti.
• Galvanotecnica: un rivestimento metallico viene applicato su un materiale che deve essere protetto dalla corrosione.
Il metallo scelto per il rivestimento - che può essere cromo (cromatura), nichel (nichelatura), argento (argentatura), oro (doratura) o zinco (galvanizzazione) – sarà l'anodo, elettrodo positivo, che subisce l'ossidazione, perdendo elettroni. Subisce ossidazione al posto del materiale che è stato protetto, perché il suo potenziale di riduzione è maggiore.
L'elettrodo negativo, cioè il catodo, che riceve questi elettroni e subisce la riduzione, è il materiale stesso che è stato rivestito. In questo modo rimane protetto anche se la sua superficie viene in qualche modo violata.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Elettrolisi con elettrodi attivi"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm. Consultato il 28 giugno 2021.
