Reazioni di solfonazione negli alcani sono reazioni di sostituzione organica, realizzato con lo scopo di produrre acidi solfonici (composti organici che hanno il gruppo SO3H attaccato ad un atomo di carbonio o ad una catena di carbonio) e acqua (H2O).
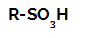
Formula di struttura di un acido solfonico
Per eseguire una reazione di solfonazione su alcani, dobbiamo mescolare un alcano (composto formato da una catena di carbonio satura di soli atomi di carbonio e idrogeno) e il acido solforico (H2SOLO4) concentrato, sottoposto a riscaldamento (∆).
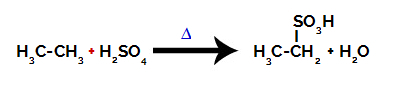
Equazione chimica che rappresenta la solfonazione di un alcano a due atomi di carbonio
Principi della reazione di solfonazione negli alcani
Ad esempio reazione di alcansolfonazione è una reazione di sostituzione, abbiamo in essa uno scambio tra componenti più piccoli elettronegatività dei reagenti, cioè tra alcano e acido solforico. L'alcano ha idrogeno e acido solforico, il gruppo solfonico.
Di seguito, abbiamo il passo dopo passo del meccanismo di a reazione di solfonazione negli alcani. Come esempio, useremo l'alcano più semplice, il metano (CH4):
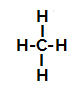
Formula di struttura del metano
1° passo: Rottura del legame tra idrossile (OH) e zolfo (S) in acido solforico.
Ciascun gruppo ossidrile presente nell'acido solforico è caratterizzato dall'essere più elettronegativo. Con il riscaldamento durante la reazione, la tendenza è che il legame tra il gruppo ossidrile e lo zolfo si rompa:
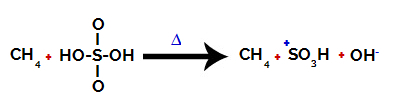
Rottura del legame tra zolfo e idrossile
Tuttavia, la rottura del legame di tutti gli ossidrili non si verifica a causa del riarrangiamento elettronico nella struttura. Si ottiene quindi un anione idrossido (OH).-) e un catione solfonico.
2° passo: Attacco del gruppo ossidrile alla molecola dell'alcano.
Quindi il gruppo ossidrile (OH-) effettua un attacco all'alcano, provocando la rottura del legame tra carbonio e idrogeno (che è più fragile a causa della differenza di elettronegatività tra di loro).
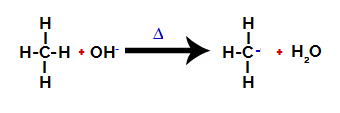
Rompere il legame tra carbonio e idrogeno in alcano
Nota: La rottura del legame tra carbonio e idrogeno si verificherà sempre più frequentemente su carbonio di densità o carica elettronica inferiore. Meno idrogeni ha il carbonio, o più gruppi ad esso legati, minore è la sua densità elettronica. Quindi abbiamo:
Carbonio terziario < Carbonio secondario < Carbonio primario
Dopo la rottura del legame, l'alcano diventa un carbonio carente di elettroni (carbocatione). Il gruppo idrossido (OH)-) interagisce con l'idrogeno rilasciato e forma una molecola d'acqua.
3° Passo: Attacco del radicale formato al gruppo solfonico.
Infine, il gruppo solfonico viene attaccato dal resto dell'alcano, formando un acido solfonico.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
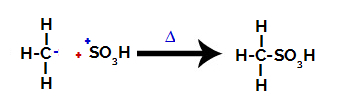
Strutture che interagiscono e formano acido solfonico
Esempi di equazioni che rappresentano reazioni di solfonazione negli alcani
1° Esempio: Solfonazione del propano.
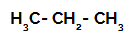
Formula di struttura del propano
Il propano ha due atomi di carbonio primari e un carbonio secondario, che hanno cariche diverse perché sono legati a diverse quantità di idrogeno. Poiché il carbonio è più elettronegativo dell'idrogeno, questi atomi di carbonio hanno densità di elettroni diverse.
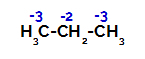
Distribuzione delle cariche su ciascun atomo di carbonio del propano
Sui carboni primari la carica è -3 (perché è legata a tre idrogeni) e sul carbonio secondario la carica è -2 (perché è legata a due idrogeni). Quindi, ci sarà una rottura nel legame tra carbonio e idrogeno, a volte al carbonio 1 (di una molecola), a volte al carbonio 2 (di un'altra molecola).
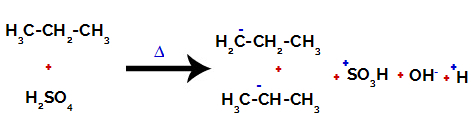
Rompere il legame tra carbonio e idrogeno su carboni diversi
Dopo la rottura tra i legami, sia nell'acido solforico che nell'alcano, si ha la formazione di prodotti con la sostituzione dell'idrogeno sul carbonio 1 con un gruppo solfonico, e lo stesso avviene sul carbonio 2.
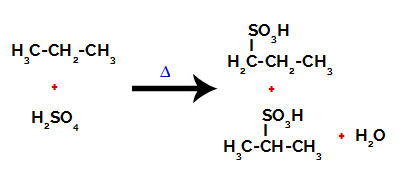
Prodotti formati dalla solfonazione del propano
2° Esempio: Solfonazione del 2-metil-butano.

Formula di struttura del 2-metil-butano
Il 2-metil-butano ha tre atomi di carbonio primari, un carbonio secondario e un carbonio terziario, che hanno differenti cariche e, di conseguenza, differenti densità elettroniche, come si può vedere nella seguente struttura:
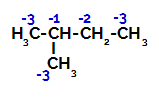
Distribuzione di cariche elettroniche in 2-metil-butano
Pertanto, ci sono nel 2-metil-butano diverse possibilità di rompere il legame tra carbonio e idrogeno, che può verificarsi su carbonio 1 (di una molecola), carbonio 2 (di un'altra molecola), carbonio 3 o carbonio 4. Tuttavia, è interessante notare che l'interruzione al numero di carbonio 2 è più comune.
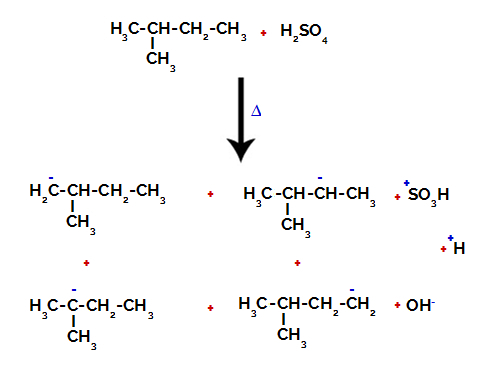
Rompere il legame tra carbonio e idrogeno su carboni diversi
Dopo le rotture tra i legami, sia nell'acido solforico che nell'alcano, la formazione di prodotti con la sostituzione dell'idrogeno sul carbonio 1 con un gruppo solfonico, e lo stesso avviene sul carbonio 2.

Prodotti formati dalla solfonazione del 2-metil-butano
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
GIORNI, Diogo Lopes. "Reazioni di solfonazione negli alcani"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm. Consultato il 28 giugno 2021.