Fin dall'antichità l'uomo si è interessato a rispondere alla domanda sulla costituzione della materia.
Diverse personalità della comunità scientifica presero posizione sull'argomento, ma fu solo alla fine del XIX secolo che i misteri sulla composizione atomica cominciarono a essere svelati.
L'antico filosofo Leucippo, ad esempio, credeva che l'atomo fosse costituito da minuscole particelle.
Dopo questa definizione, Democrito e Dalton proposero che le particelle atomiche fossero massicce e indivisibili.
Questo fatto fu poi contestato da Thomson, un fisico inglese che scoprì l'esistenza dell'elettrone e poté, quindi, confermare l'idea precedentemente proposta da Leucipo.
Dopo questa scoperta, Thomson presentò un modello in cui l'atomo era formato da una sfera di cariche positive e all'interno del nucleo vi erano degli elettroni.
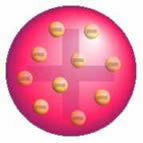
Modello dell'atomo di Thomson - In una sfera di massa caricata positivamente e uniformemente distribuita,
sarebbero incrostati di elettroni carichi negativamente, come in un budino.
Anche dopo la teoria di Thomson, il modello atomico presentava ancora una carenza teorico-sperimentale, capace di dimostrarne la veridicità.
L'argomento è stato ancora una volta discusso calorosamente quando il team del fisico Rutherford ha notato che c'era una deviazione molto grande (e inspiegabile, secondo la teoria del budino all'uvetta) quando alcune particelle alfa radioattive passavano attraverso un sottile strato di lamina metallico.
Dopo aver analizzato e studiato il fatto, Rutherford arrivò alla conclusione che il raggio dell'atomo è 10.000 volte più grande del raggio del nucleo.
Attraverso tutto lo studio dell'atomo, Rutherford e il suo team arrivarono, nel 1911, a un modello atomico, che chiamarono modello planetario dell'atomo.

Nel 1913, Niels Bohr decifrò il modello atomico, applicando ai suoi studi il quanto dazione scoperto da Planck. Il quanto dazione era, infatti, il grande jolly che sarebbe venuto a completare e chiarire il modello atomico.
Bohr adeguò in modo efficiente e semplice il modello presentato da Rutherford giungendo alla seguente conclusione:
L'elettrone acquisisce energia, che viene rappresentata attraverso un'orbita definita. Le orbite consentite formano i livelli di energia.

Di Talita A. angeli
Laureato in Fisica
Squadra scolastica brasiliana
Fisica Moderno - Fisica - Brasile Scuola
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/fisica/do-atomo-rutherford-ao-atomo-bohr.htm
