IL energia di attivazione è la quantità minima di energia necessaria affinché l'urto tra le particelle reagenti, effettuato con un orientamento favorevole, abbia luogo e provochi una reazione.
Le reazioni si verificano solo quando i reagenti hanno energia di attivazione (o l'energia minima necessaria, che varia da reazione a reazione; in quantità o forma) o quando viene loro fornito.
Ad esempio, quando il sodio metallico viene a contatto con l'acqua, reagisce violentemente. Ciò significa che il contenuto energetico di questi reagenti è già sufficiente affinché la reazione abbia luogo.
Nel caso di accensione di una stufa, la reazione di combustione avverrà solo se poniamo un fiammifero acceso o qualche altra fonte di fuoco vicino al gas che viene rilasciato dalla stufa. Ciò significa che, in questo caso, era necessario fornire energia al sistema affinché raggiungesse l'energia di attivazione e la reazione avvenisse.
Nel caso del fosforo stesso utilizzato, per la sua combustione, l'energia di attivazione è fornita dall'attrito. Lo stesso accade con gli accendini, che necessitano anche di una scintilla che dia l'energia di attivazione necessaria per la combustione del gas contenuto al loro interno.
L'energia di attivazione può essere fornita anche dalla luce, come nel caso della decomposizione del perossido di idrogeno. Ecco perché viene conservato in bottiglie scure o opache.

Quindi, possiamo concludere che l'energia di attivazione (Efino a) è la differenza tra l'energia necessaria per l'inizio della reazione (E) e l'energia contenuta nei reagenti (Eprima):

L'energia di attivazione è un ostacolo affinché la reazione abbia luogo ed è necessaria per rompere i legami dei reagenti. Con questo avviene la reazione e si creano nuove connessioni per formare i prodotti.
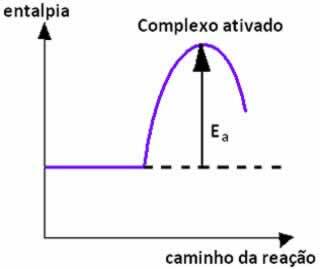
Quando la collisione tra particelle di reagenti con orientamento favorevole avviene con uguale o superiore all'energia di attivazione, prima della formazione dei prodotti, si forma uno stato intermedio e instabile, denominato complesso attivato, in cui i legami reagenti si indeboliscono e si formano i legami prodotto. Così, l'energia di attivazione è l'energia necessaria per formare il complesso attivato.
Di seguito abbiamo un grafico che mostra l'energia di attivazione come barriera affinché la reazione abbia luogo:
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/energia-ativacao.htm

