Per capire perché quando bruciamo la legna, questa non si scioglie, ricordiamo innanzitutto cos'è una sostanza fusa, cioè allo stato liquido.
La differenza tra stato solido, liquido e gassoso è solo nello stato di aggregazione delle particelle. Nei tre stati, la sostanza è composta dalle stesse particelle, ma c'è più o meno spazio tra di loro.
Allo stato solido, le particelle sono più vicine tra loro, senza molta libertà di movimento. Allo stato liquido, le particelle hanno più libertà e possono muoversi.
Si scopre che gran parte del legno (50%) è costituito da cellulosa, che in realtà è un polimero. Un polimero è formato dall'unione di più molecole, dette monomeri. Nel caso della cellulosa, è formata dall'unione di centinaia di molecole di -glucosio, come mostrato di seguito. La cellulosa ha allora la formula (C6H10oh5)no e raggiunge masse molecolari dell'ordine di 400.000 u.
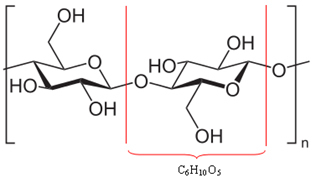
Poiché sono molecole enormi, questi polimeri che compongono il legno non possono muoversi facilmente. Inoltre, si noti che le molecole di -glucosio che compongono la cellulosa hanno gruppi ossidrile (─ OH). Questi gruppi legano tra loro l'idrogeno, che è il tipo più intenso di forza intermolecolare, mantenendo il polimero strettamente insieme.

Legami idrogeno tra le molecole che compongono il polimero cellulosico*
Così, per rompere questi legami bisognerebbe mettere così tanta energia nel sistema che il legno si decompone ancor prima di sciogliersi e poi non è più legno.
Pertanto, quando viene bruciato, il legno subisce una reazione chimica, che è più di un semplice cambiamento di stato fisico. Le sue molecole finiscono per rompersi e ricombinarsi con l'ossigeno presente nell'aria, formando quindi nuove sostanze, come gas di carbonio e acqua.

* fonte e autore dell'immagine: laghi.l.
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/por-que-madeira-nao-derrete.htm