isomeri attivi o isomeri otticamente attivi (IOA) sono molecole di una certa sostanza chimica in grado di effettuare la polarizzazione e la deviazione del piano di leggero destra o sinistra. Per verificare se una sostanza ha o meno isomeri attivi, basta controllare se c'è un carbonio asimmetrico nella sua formula di struttura:

Analizzando la catena rappresentata nell'immagine sopra, possiamo vedere che il il carbonio centrale ha quattro diversi ligandi (OH, H,CH3 e Cl), che lo rende a carbonio asimmetrico, chiamato anche carbonio chirale. Quindi, ogni volta che una catena ha uno o più atomi di carbonio chirali, ci saranno isomeri attivi.
voi tipi di isomeri attivi(IOA) sono:
Destro: Isomero ottico attivo che piega la luce polarizzata a destra;
Levogiro: Isomero ottico attivo che piega la luce polarizzata a sinistra.
Osservazione: La presenza di carbonio asimmetrico in una formula strutturale indica che la sostanza deve avere l'isomero levogiro e l'isomero destrogiro. Non sta a noi sapere da che parte è stata deviata la luce, poiché la presenza del carbonio chirale lo dimostra già. Sempre la metà delle molecole esistenti è mancina e l'altra metà è destrorsa.
Le molecole sinistrorse e destrorse di qualsiasi sostanza organica hanno sempre le stesse proprietà fisiche (punto di fusione, punto di ebollizione, densità, solubilità ecc.), ma presentano attività chimiche (comportamento nell'organismo) tante differenti. Un esempio è l'adrenalina. Solo la molecola di adrenalina levogyra agisce nel corpo, mentre la destrogira no.
Vedi ora la formula strutturale della sostanza butan-2-olo per verificare se ha o meno isomeri attivi:
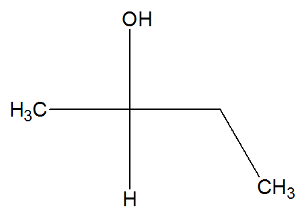
Possiamo osservare, nella struttura del butan-2-olo, che il carbonio 2 ha quattro diversi raccoglitori (OH, H,CH3, CH2-CH3), quindi è un carbonio chirale e presenta un isomero attivo destrogiro e un altro isomero attivo levogiro.
Calcolo degli isomeri attivi (IOA)
Il chimico olandese Jacobus Henricus van't Hoff ha sviluppato una formula che consente di calcolare quanti isomeri attivi (IOA) può presentare una determinata sostanza. Guarda:
IOA: 2no
n: è il numero di atomi di carbonio chirali nella formula di struttura della sostanza.
Segui due esempi di applicazione della formula Vant't Hoff:
Acido 5-dicloro-2,3-diidrossi-esandioico

Nella formula strutturale del composto, ci sono tre carboni chirali o asimmetrico, quindi:
IOA = 2no
IOA = 23
IOA = 8
2,3,4,5-tetraidrossiesanale

Nella formula strutturale del composto, ci sono quattro carboni chirali (frecce rosse) o asimmetrico, quindi:
IOA = 2no
IOA = 24
IOA = 16
Osservazione: Esiste la possibilità che una formula strutturale abbia due atomi di carbonio asimmetrici che hanno esattamente gli stessi ligandi. Se ciò si verifica, consideriamo nei calcoli solo 1 per il valore di n, non 2. Vedi un esempio:
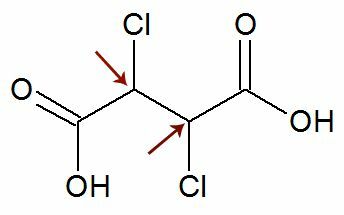
Piace due atomi di carbonio chirali sono è uguale a, ne consideriamo solo uno carbonio nel calcolo:
IOA = 2no
IOA = 21
IOA = 2
Di Me. Diogo Lopes Dias
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm

