IL idrolisi del sale tra acidi e basi forti si verifica quando il catione in un sale non interagisce con l'anione nell'acqua e l'anione nel sale non interagisce con il catione nell'acqua. L'idrolisi tra cationi e anioni di un sale e dell'acqua si verifica solo quando il prodotto formato è un acido debole, una base debole o entrambi. Comprendere passo dopo passo l'idrolisi del sale tra acidi forti e basi forti:
a) Passaggio 1: ionizzazione dell'acqua
L'acqua è una sostanza che ha la capacità di soffrire autoionizzazione, cioè produce catione idronio (H+) e anione idrossido (OH-) dalla sua struttura.
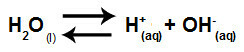
Equazione che rappresenta l'autoionizzazione dell'acqua
b) Passaggio 2: Dissociazione di sale
Quando un sale viene aggiunto all'acqua, passa attraverso il processo di dissociazione. Poiché il sale è un composto ionico, nell'acqua i suoi cationi e anioni vengono rilasciati nel mezzo, come nell'equazione mostrata di seguito:
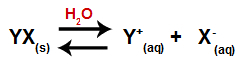
Equazione che rappresenta la dissociazione di qualsiasi sale
c) Passaggio 3: idrolisi salina di acidi e basi forti
Per acido forte: quando l'anione del sale si combina con l'H+ di acqua per formare HCl, HBr, HI o un altro acido in cui la sottrazione del numero di ossigeni per il numero di idrogeni è uguale o maggiore di 2, avremo un acido forte. Pertanto, la combinazione tra gli ioni citati non si verifica.
Per fondamenta solide: quando il catione del sale appartenente alle famiglie IA (metalli alcalini) o IIA (metalli alcalino terrosi diversi dal magnesio) è combinato con l'OH- di acqua, si formerà un solide fondamenta. Pertanto, la combinazione tra gli ioni citati non si verifica.
Quando gli ioni del sale non interagiscono con gli ioni dell'acqua, abbiamo la seguente equazione:
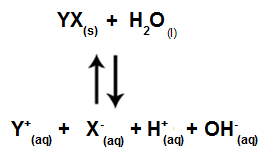
Equazione che mostra tutti gli ioni presenti nella soluzione
In sintesi, poiché gli ioni sale non interagiscono con gli ioni acqua, gli ioni sale non promuovono alcun cambiamento nella soluzione finale. Quindi, possiamo scrivere l'equazione di un'idrolisi salina tra acidi forti e basi forti solo con l'equazione di ionizzazione dell'acqua.
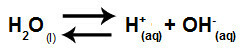
Equazione che rappresenta l'idrolisi di acidi e basi forti
d) Esempio di idrolisi salina tra acidi e basi forti
Quando aggiungiamo il sale di clorato di potassio all'acqua (KClO3), il sale si dissocia e rilascia il catione potassio (K+) e l'anione clorato (ClO3-) nel mezzo.
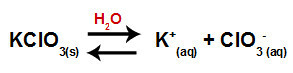
Equazione di dissociazione per clorato di potassio
È importante ricordare che l'acqua si autoionizza e fornisce al mezzo il catione idronio (H+) e anione idrossido (OH-). Dobbiamo ora valutare l'interazione tra ioni sale e acqua.
Quando l'H+ interagisce con ClO3-, forma acido perclorico (HclO3). Poiché la sottrazione del numero di ossigeni per il numero di idrogeni ionizzabili nell'acido perclorico è 2, è forte. Pertanto, l'interazione tra gli ioni non si verifica.
Quando il catione K+ interagisce con l'anione OH-,abbiamo la formazione di una base forte, in quanto il potassio è un metallo alcalino. Pertanto, l'interazione tra gli ioni non si verifica.
L'equazione che rappresenta l'idrolisi salina tra acidi e basi forti dalla dissoluzione del clorato di potassio in acqua è:
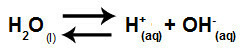
Equazione chimica dell'idrolisi del clorato di potassio
Di Me. Diogo Lopes Dias
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm
