Poiché esistono migliaia di composti organici, il fenomeno dell'isomerismo può assumere diverse forme. Pertanto, l'isomerismo può essere sostanzialmente classificato in due tipi: isomeria piatta o costituzionale e isomeria spaziale o stereoisomeria. Ogni tipologia citata può essere suddivisa, come mostrato nello schema seguente:
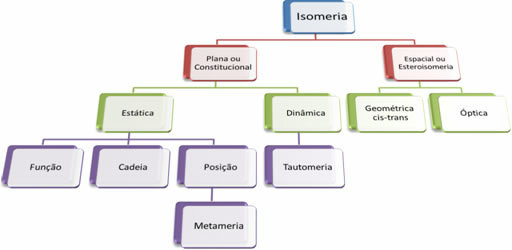
Vedi ogni caso:
1. Isomeria piatta o costituzionale: Gli isomeri di questo tipo hanno la stessa formula molecolare e si differenziano per formule di struttura piatte. Esistono cinque casi di isomeria piana: funzione, catena, posizione, metamerismo e tautomeria.
1.1.Isomeria funzionale o funzionale: La differenza tra gli isomeri è nel gruppo funzionale.
Esempio: formula molecolare C3H6oh
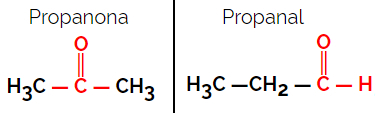
Si noti che il propanone appartiene al gruppo chetonico e il propanale al gruppo aldeidico.
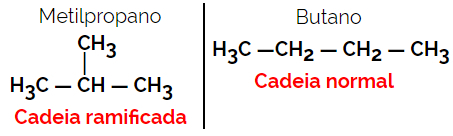
1.2. Isomeri a catena o scheletrici: La differenza tra gli isomeri sta nel tipo di catena. Ad esempio, un isomero è a catena aperta e l'altro a catena chiusa, oppure uno è a catena normale e l'altro a catena ramificata, oppure uno è una catena omogenea e l'altro è una catena eterogenea.
Esempio: formula molecolare C4H10
1.3.Isomeria posizionale o posizionale: La differenza sta nella posizione di un'insaturazione, un gruppo funzionale, un eteroatomo o un sostituente.
Esempio: formula molecolare C4H6

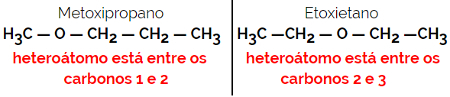
1.4.Isomeria di compensazione o metameria: È un tipo speciale di isomeria di posizione, in cui la differenza è la posizione dell'eteroatomo.
Esempio: formula molecolare C4H10oh
1.5.Isomeria dinamica o tatomeria: È un tipo speciale di isomeria di funzione, in cui gli isomeri coesistono in equilibrio dinamico in soluzione. I due principali tipi di tautomeria sono tra un chetone ed un enolo (equilibrio chetoenolico) e tra un'aldeide e un enolo (equilibrio aldoenolo).
Esempio: formula molecolare C3H6oh
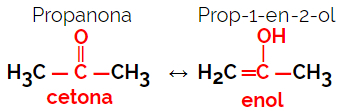
2. Isomeria spaziale o stereoisomeria: In questo caso, la differenza tra gli isomeri può essere visualizzata solo attraverso l'orientamento dei loro atomi nello spazio. Esistono due tipi di stereoisomeria: isomeria geometrica e isomeria ottica.
2.1.Isomeri geometrici o cis-trans: La differenza è che l'isomero chiamato as cis ha gli stessi leganti di carbonio in un doppio legame o in composti ciclici sullo stesso lato del piano. I ligandi isomerimer trans sono su lati opposti.
Esempio: formula molecolare C2H2Cl2

Questi composti sono chiamati stereoisomeri.
2.2.Isomero ottico: Si verifica quando gli isomeri sono in grado di deviare un raggio di luce polarizzata. Se piega il raggio di luce polarizzata a sinistra, è un isomero levogiro, ma se piega a destra è chiamato isomero destrorso.
Esempio:
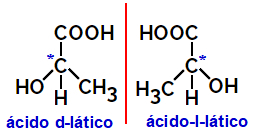
Molecole asimmetriche come quelle mostrate sopra, che sono immagini speculari l'una dell'altra e che non sono sovrapponibili, sono chiamate enantiomeri.
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm
