Base è sostanza inorganica che, secondo il chimico svedese Svante Arrhenius, quando posto in acqua, subisce il fenomeno di dissociazione ionica, in cui vi è il rilascio di ioni: catione (Y+) e anione idrossido (OH-).

Formula generale di una base di Arrhenius
il gruppo Y di a base può essere qualsiasi metallo oppure del gruppo ammonio (NH4+), che vengono rilasciati in acqua come cationi durante la dissociazione, come si vede nell'equazione che rappresenta il processo:
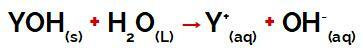
Equazione che rappresenta la dissociazione di una base
Si vedano di seguito alcune informazioni molto importanti riguardanti la classificazione e la nomenclatura di basi.
1) Classificazione relativa al solubilità delle basi(capacità di dissolvere in acqua)
basi solubile: hanno metallo alcalino o ammonio nella composizione;
basi poco solubile: avere metallo alcalino-terroso nella composizione. Esempio: idrossido di magnesio, ampiamente usato come antiacido e lassativo;
basi praticamente insolubile: hanno qualsiasi altro metallo nella composizione. Esempio: idrossido di alluminio, ampiamente usato come antiacido.
2) Classificazione relativa al forza di base(capacità di dissociarsi in acqua)
basi forte: hanno nella composizione metalli alcalini o alcalino terrosi, ad eccezione del magnesio;
basi debole: hanno qualsiasi altro metallo nella composizione.
3) nomenclatura di base
Per nominare una base, basta seguire la regola di denominazione di seguito:
Idrossido + de + nome di metallo o ammonio
Esempio: Ca(OH)2 → idrossido di calcio
Se la base ha un elemento chimico che non appartiene alle famiglie IA, IIA o IIIA (e che non è il argento o zinco), dobbiamo indicare davanti al nome dell'elemento, in numeri romani, il numero di idrossili:
Esempio: Ti (OH)4 → idrossido di titanio IV
Di Me. Diogo Lopes
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm
