IL solubilità, o coefficiente di solubilità, è una proprietà fisica della materia che è sempre praticamente determinata in laboratorio. È legato alla capacità che un materiale, chiamato soluto, presenta per essere sciolto da un altro, il solvente.
Per quanto riguarda la solubilità, i soluti possono essere classificati come segue:
Solubili: quelli che si sciolgono nel solvente. Il cloruro di sodio (soluto), ad esempio, è solubile in acqua (solvente);
Leggermente solubile: quelli che hanno difficoltà a dissolversi nel solvente. Questo è il caso dell'idrossido di calcio [Ca(OH)2] (soluto) in acqua;
Insolubili: quelli non si sciolgono nel solvente. La sabbia (soluto), per esempio, è insolubile in acqua.
IL solubilità è molto legato alla preparazione di soluzioni (miscele omogenee), poiché, per ottenere una soluzione, è essenziale che il soluto utilizzato sia solubile nel solvente.
Fattori che influenzano la solubilità
Anche quando il soluto è solubile nel solvente, ci sono alcuni fattori che possono influenzare la capacità del soluto di dissolversi. Sono loro:
a) Relazione tra la quantità di soluto e solvente
Il solvente ha sempre un limite di soluto che può dissolvere. Se aumentiamo la quantità di solvente mantenendo la quantità di soluto, il solvente tende a dissolvere tutto il soluto utilizzato.
B) Temperatura
La temperatura è l'unico fattore fisico in grado di modificare la solubilità di un solvente rispetto a un dato soluto. Questa modifica dipende dalla natura del soluto, come vedremo di seguito:
soluto endotermico: è quello che riusciamo a sciogliere una massa più grande, purché il solvente sia ad una temperatura superiore a quella ambiente. Più caldo è il solvente, più soluto si dissolverà.
Esempio: È possibile sciogliere una quantità maggiore di caffè macinato quando l'acqua è calda.
Soluto esotermico: è quello che riusciamo a sciogliere una massa più grande, purché il solvente sia ad una temperatura inferiore a quella ambiente. Più freddo è il solvente, più soluto si dissolverà.
Esempio: È possibile sciogliere una maggiore quantità di anidride carbonica quando la soda è fredda.
Modi per determinare la solubilità
Essendo la solubilità una proprietà determinata in via sperimentale, i materiali, in genere, hanno già fatto valutare la loro solubilità nei più diversi solventi. Pertanto, possiamo accedere alla solubilità di un soluto in un determinato solvente come segue:
a) Analisi di una tabella
Spesso lo studente può imbattersi in solubilità nell'interpretazione di una tabella. Vedere il seguente esempio:
Esempio: (UEPG - adattato) La tabella seguente mostra la solubilità del sale di Li2CO3 in 100 grammi di acqua.

La tabella presenta i valori di massa in grammi di Li2CO3 che può essere sciolto in 100 grammi di acqua, da 0 ohC a 50 oh. Possiamo vedere che più calda è l'acqua, meno Li2CO3 si dissolve. Pertanto, Li2CO3 è un soluto esotermico (si dissolverà di più se l'acqua è fredda).
b) Analisi di un grafico
La solubilità può essere valutata interpretando un grafico. Per fare ciò, è sufficiente determinare la temperatura, ruotarla sulla curva e quindi ruotare la curva sull'asse y, che è la massa in grammi di soluto che verrà dissolto.
Esempio: (UFTM - adattato) Il grafico mostra la curva di solubilità di un sale AX2.
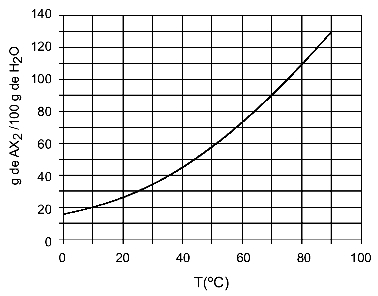
Il grafico dice che, sull'asse y, la quantità di acqua (solvente) è 100 grammi. Per soluto AX2, determineremo la quantità di acqua alle seguenti temperature:
30oh: Quando accendiamo la temperatura 30ohC alla curva e poi la curva all'asse y, abbiamo che, a questa temperatura, i 100 grammi di acqua possono sciogliere circa 35 grammi di soluto AX2.
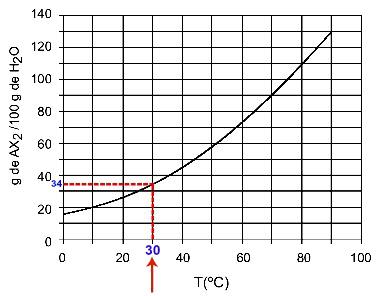
Determinazione della solubilità di AX2 a 30ohÇ
40oh: Quando accendiamo la temperatura 40ohC alla curva e poi la curva all'asse y, abbiamo che, a questa temperatura, i 100 grammi di acqua possono sciogliere circa 45 grammi di soluto AX2.
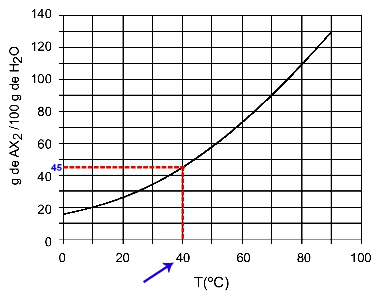
Determinazione della solubilità di AX2 a 40ohÇ
Poiché la quantità di soluto disciolta è maggiore ad ogni aumento di temperatura, abbiamo che AX2 è un soluto endotermico.
c) interpretazione testuale
Vedere il seguente esempio:
Esempio: (PUC-MG) Alcune sostanze sono in grado di formare miscele omogenee con altre sostanze. La sostanza che è in quantità maggiore è chiamata solvente e quella che è in quantità minore è chiamata soluto. Il cloruro di sodio (NaCl) forma con acqua una soluzione omogenea, nella quale è possibile solubilizzare, a 20ºC, 36 g di NaCl in 100 g di acqua.
Il testo afferma che se abbiamo 100 grammi di acqua (solvente), ad una temperatura di 20 ohC, è possibile sciogliere fino a 36 grammi di NaCl.
Di Me. Diogo Lopes Dias
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm
