Il ghiaccio secco è così chiamato perché pur avendo l'aspetto di ghiaccio (acqua allo stato solido), è in realtà anidride carbonica solida (anidride carbonica - CO2). E, a differenza del normale ghiaccio che si scioglie, passa direttamente allo stato gassoso, cioè sublima.
Questa è la proprietà più importante del ghiaccio secco, perché quando passa allo stato gassoso trascina con sé le molecole d'acqua, creando una nebbia più densa dell'aria. grazie a questo "Fumo bianco" formato, il ghiaccio secco è ampiamente utilizzato come risorsa scenica in film, concerti, teatri, programmi televisivi e feste.
Ma sorge spontanea la domanda: cosa c'è di diverso nel ghiaccio secco dalle altre sostanze coinvolte nella sua sublimazione? Cosa succede tra le tue molecole?
L'anidride carbonica non è polare, quindi quando è allo stato solido, come il ghiaccio secco, è le molecole rimangono nei cristalli molecolari grazie a una forza di attrazione intermolecolare tra di loro, qual è dipolo indotto. Questa forza sorge quando le tue molecole si avvicinano e c'è una repulsione tra i tuoi elettroni, portando a deformazioni momentanee nelle tue nuvole elettroniche. Ciò significa che nelle molecole compaiono dipoli momentanei, che inducono molecole adiacenti, determinando forze attrattive.
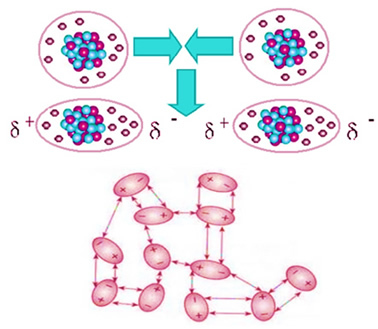
Questa è l'unica forza intermolecolare presente nelle molecole non polari del ghiaccio secco e la sua intensità è molto piccola. La forza di dipolo indotto è la più debole di tutte. Così, ci vuole poca energia per spezzare queste forze di attrazione e fanno cambiare il composto al suo stato fisico. Ecco perché il ghiaccio secco sublima a -78,6°C, sotto una pressione di 1 atm.
Altri esempi di sostanze che hanno anche questo tipo di interazione intermolecolare e che sublimano sono anche naftalina è il iodio solido.

di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/por-que-gelo-seco-sublima.htm
