Il legame covalente si verifica quando due atomi condividono coppie di elettroni per acquisire la configurazione elettronica di an gas nobile (con 8 elettroni nel guscio di valenza o con 2, nel caso di quelli con solo guscio K), secondo la regola di ottetto.
Tuttavia, ci sono casi speciali di legami covalenti in cui la coppia di elettroni condivisa proviene solo da uno degli atomi che è già stabile. In precedenza, questo tipo di legame covalente era chiamato dativo, oggi è più comunemente chiamato coordinata.
Guarda alcuni esempi per capire come questo accade:
- CO (monossido di carbonio):
Il carbonio ha 4 elettroni nel suo guscio di valenza. Pertanto, secondo la regola dell'ottetto, per essere stabile, ha bisogno di ricevere 4 elettroni in più, per un totale di 8. L'ossigeno, invece, ha 6 elettroni nel guscio di valenza e ha bisogno di ricevere 2 elettroni per ottenere la configurazione del gas nobile neon.
Quindi, in primo luogo, il carbonio e l'ossigeno condividono due coppie di elettroni in modo che l'ossigeno sia stabile:
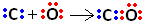
Tuttavia, il carbonio rimane instabile poiché ha ancora 6 elettroni e ne necessita 2. Pertanto, l'ossigeno, che è già stabile, condivide una delle sue coppie di elettroni con il carbonio, cioè fa con esso un legame dativo, rendendolo stabile:

Nota che il legame covalente coordinato può essere rappresentato da un trattino, proprio come il legame covalente comune.
- SOLO2 (Diossido di zolfo):
Ogni atomo di zolfo e ossigeno ha 6 elettroni nei loro gusci di valenza, quindi devono ricevere 2 elettroni ciascuno. Inizialmente, lo zolfo forma due legami covalenti comuni, condividendo due coppie di elettroni con uno degli atomi di ossigeno, rimanendo entrambi stabili con 8 elettroni.
Ma l'altro atomo di ossigeno non è stabile, quindi lo zolfo condivide con esso una coppia dei suoi elettroni tramite un legame covalente coordinato o dativo:
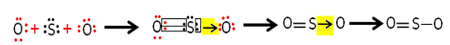
Nota che in questo caso abbiamo tre atomi nella molecola, quindi può esserci una migrazione del legame da un atomo all'altro. La molecola di anidride solforosa può anche essere rappresentata così: O ─ S ═ O.
Chiamiamo questo fenomeno di legame risonanza. Vedi altri tre esempi nella tabella seguente:
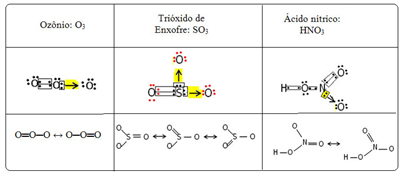
Le strutture possibili sono chiamate strutture di risonanza o forme canoniche.
Questo tipo di legame si verifica anche nella formazione di ioni, come nel caso degli ioni idronio (H3oh+) e ammonio (NH4+).
Primo, il catione H+ si forma quando l'idrogeno perde il suo singolo elettrone, lasciandolo con una carica positiva. Quindi dovrà ricevere due elettroni per essere stabile. Ciò avviene attraverso un legame dativo con l'acqua (nel caso dello ione idronio) e con l'ammoniaca (nel caso dello ione ammonio). Orologio:

di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm
